Ю.Э. Доброхотова1, М.Р. Нариманова1, Л.В. Сапрыкина1, И.Ю. Ильина1, А.З. Хашукоева1, М.Л. Мазо2
1Российский национальный исследовательский медицинский университет имени Н.И. Пирогова; 117997, Россия, Москва, ул. Островитянова, д. 1
2Московский научно-исследовательский онкологический институт имени П.А. Герцена – филиал Национального медицинского исследовательского центра радиологии; 125834, Россия, Москва, 2-й Боткинский проезд, д. 3, стр. 2
Резюме
Введение. На фоне неуклонного роста частоты гиперпластических процессов, как матки, так и молочных желез, многочисленные исследования отмечают наличие у женщин с дисгормональной патологией молочных желез ряда гинекологических заболеваний (наружный или внутренний эндометриоз, гиперпластические процессы эндо- и миометрия, полипы, синдром поликистозных яичников (СПКЯ) и других.
Цель исследования. Оценить состояние молочных желез (МЖ) у женщин пременопаузального возраста с гиперплазией эндометрия на фоне применения индол-3-карбинола (I3C).
Материалы и методы. В открытое проспективное исследование были включены 42 пациентки пременопаузального возраста с 45 до 52 лет (48,54 ± 1,83 г.). Все пациентки получали I3C 400 мг/сутки в течение 12 мес. Обследование включало в себя клинико-лабораторное обследование, ультразвуковое (УЗИ) и маммографическое исследование МЖ, цитологическое исследование выделений из соска. Исследования выполняли на этапе включения и через 6 и 12 мес. после начала лечения. Для оценки данных использовали описательную статистику. Различия считались достоверными при р<0,05.
Результаты и обсуждение. У всех пациенток до начала лечения наблюдалась масталгия. При УЗИ МЖ было выявлено, что частота BI-RADS 2 в 9,5 раза выше, чем BI-RADS 1 (90,5% и 9,5 % соответственно; р<0,05). При маммографии было выявлено, что частота BI-RADS 2 в 9,26 раза выше, чем BI-RADS 1 (88% и 9,5% соответственно; р<0,05). Через 6 мес. 59,5% пациенток отметили исчезновение болевого синдрома, количество пациенток с отклонениями ОНЕ1/16а-ОНЕ1 уменьшилось на 22%, улучшение УЗ-картины по Bi-RADS произошло у 7,1% пациенток. Через 12 мес. терапии количество пациенток с отклонениями ОНЕ1/16а-ОНЕ1 уменьшилось на 92,86% по сравнению с показателями до начала лечения, улучшение картины Bi-RADS по данным УЗИ произошло у 19% пациенток, по данным маммографии у 28,5%.
Выводы. I3C эффективный и безопасный метод для лечения диспластических доброкачественных заболеваний молочных желез у женщин пременопаузального возраста. Целесообразно рассматривать применение комбинации индол-3-карбинола с антиоксидантом ресвератролом в клинической практике.
Заключение. Терапию индол-3-карбинолом можно оценить, как имеющую влияние на общие звенья патогенеза гиперплазии эндометрия и доброкачественных гиперпластических процессов в молочной железе.
Ключевые слова: Индол-3-карбинол; I3C; ресвератрол; гиперплазия эндометрия; пременопаузальный возраст; негормональное лечение; эффективность; масталгия; BI-RADS; маммография; ультразвуковое исследование; молочные железы
Введение
В последние годы наблюдается неуклонный рост частоты гиперпластических процессов как матки, так и молочных желез. Многочисленные исследования отмечают наличие у женщин с дисгормональной патологией молочных желез ряда гинекологических заболеваний (наружный или внутренний эндометриоз, гиперпластические процессы эндо- и миометрия, полипы, синдром поликистозных яичников (СПКЯ) фоновые и предраковые заболевания шейки матки) с частотой 92,5 ± 1,77%. У большинства обследованных больных патология молочных желез выявлялась в среднем на 3-5 лет раньше, чем различные гиперпластические процессы эндо- и миометрия, хотя СПКЯ и воспалительные процессы органов малого таза предшествовали патологии молочных желез. И, наоборот, у больных с гинекологическими заболеваниями внутренних половых органов (эндометриоз, миома матки, гиперплазия эндометрия) частота гиперпластических процессов молочных желез колеблется от 60 до 95% [1-3].
По данным других авторов при обследовании женщин с заболеваниями молочных желез регистрируются гиперпластические процессы эндо- миометрия в 83,7% случаев [4]. Актуальность проблемы сочетанных опухолей молочной железы и гиперпластических процессов матки обусловлена общим патогенезом гормонального дисбаланса.
Общими звеньями патогенеза данных патологических гиперпластических процессов являются повышенная пролиферативная активность клеток, экспрессия факторов роста, снижение активности апоптоза, активизация компонентов неоангиогенеза [5]. Существует четкая связь между активностью метаболитов эстрогена и развитием процессов гиперплазии в эстрогенозависимых тканях. Изучение функций двух метаболитов эстрогена (2-ОНЕ1 и 16α-ОНЕ1) позволило выявить однозначную связь между уровнем 16α-ОНЕ1 и риском развития опухолей в эстрогенозависимых тканях. С одной стороны, 16α-ОНЕ1 обладает некоторыми особенностями химической структуры, позволяющими ему образовывать ковалентные связи с эстрогеновыми рецепторами, в результате чего продолжительность эстрогензависимого пролиферативного сигнала возрастает с нескольких часов до нескольких дней. С другой стороны, 16α-ОНЕ1 может индуцировать канцерогенные эффекты. В то же время при повышении уровня 2-ОНЕ1 наблюдалась тенденция к гибели опухолевых клеток и профилактике их дальнейшего образования. Многочисленные эксперименты in vivo доказали необходимость поддержания такого баланса между этими метаболитами, при котором концентрация 2-ОНЕ1 должна превышать концентрацию 16α-ОНЕ1 как минимум в 2 раза и более. Отношение 2-ОНЕ1 к 16α-ОНЕ1 (2-ОНЕ1/16α-ОНЕ1) является биомаркером, надежным диагностическим критерием при определении риска и прогноза развития эстрогенозависимых опухолей [6-9].
В настоящее время для лечения гиперплазии эндометрия в основном используются гормональные препараты, такие как прогестагены, агонисты гонадотропин-рилизинг гормона [10,11]. Для лечения доброкачественной дисплазии молочной железы также применяются гормональные препараты на основе прогестерона, антигонадотропины, антагонисты эстрогена и дофаминомиметики. Несмотря на высокую эффективность данных групп препаратов они имеют ограничения к широкому применению в практике акушера-гинеколога, связанные с необходимостью дообследования пациентки перед их рекомендацией и рисками различных побочных эффектов.
В связи с этим внимание исследователей в последние годы обращено к фитонутриентам. Преимуществом их применения является низкая частота побочных эффектов и безопасность. Установлено, что некоторые растительные экстракты и витамины могут ингибировать процессы метаболизма, связанные с развитием рака груди, реализуя эпигенетические изменения.
Эпигенетика относится к модификациям активности и экспрессии генов без изменения последовательности ДНК. Окружающая среда и диета влияют на экспрессию генов. Модификации диеты путем включения определённых нутриентов имеет значение для профилактики и лечения как хронических заболеваний, так и онкологических процессов. Диетические биоактивные соединения, такие как полифенолы (куркумин, ресвератрол, галлат эпигаллокатехина) или продукты, образующиеся при расщеплении глюкозинолатов (сульфорафан, индол-3-карбинол), могут регулировать ацетилирование гистонов [12].
Опубликованный Liu X. et al. [13] метаанализ 13 исследований (11 исследований «случай-контроль» и 2 когортных исследования) показал, что высокое потребление овощей семейства крестоцветных было связано с 15% снижением риска рака груди. В исследовании Zhang N.Q. et al. [14] c 2991 участником потребление овощей семейства крестоцветных снизило риск рака груди почти на 50%. Преимущество диеты, содержащей крестоцветные, в значительной степени связано с высоким содержанием индол-3-карбинола в их составе. Было установлено, что I3C обладает уникальной особенностью значительно снижать возникновение опухолей в гормонально зависимых органах [15-19].
Индол-3-карбинол обладает способностью селективно индуцировать апоптоз, ингибировать факторы роста и цитокины, стимулирующие пролиферацию тканей молочной железы, изменять метаболизм эстрогенов в направлении преобладания антиканцерогенного метаболита [20–23].
Целью исследования явилось изучить состояния молочных желез у женщин с гиперплазией эндометрия на фоне применения индол-3-карбинола.
Материалы и методы
На кафедре акушерства и гинекологии лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России (зав. кафедрой д.м.н., проф. Доброхотова Ю.Э) было выполнено открытое проспективное исследование. В исследование были последовательно включены 42 пациентки, которым было проведено комплексное гинекологическое и маммологическое обследование. Возраст пациенток варьировался от 45 до 52 лет (48,54±1,83).
Критериями включения в исследование являлись наличие у пациенток гиперплазии эндометрия с морфологической верификацией диагноза, категорический отказ от гормональной терапии и добровольное информированное согласие пациенток. Показаниями к выполнению раздельного диагностического выскабливания под контролем гистероскопии во всех случаях были обильные маточные кровотечения. У всех пациенток данные морфологического исследования свидетельствовали о гиперплазии эндометрия без атипии [24-27]. Критериями исключения были гиперпластические процессы с атипией и злокачественная патология любой локализации.
В план обследования входили следующие методы: клинико-анамнестический, лабораторный, ультразвуковое и маммографическое исследование молочных желез, цитологическое исследование выделений из соска при их наличии.
Всем пациенткам после проведения гистероскопии, раздельного диагностического выскабливания и получения морфологической верификации был назначен индол-3-карбинол(I3С) в дозировке 400 мг в сутки на 12 мес.
Контроль эффективности проводимой терапии осуществляли при динамическом наблюдении, включавшем клиническое обследование. Через 6 мес. и 12 мес. проводилась оценка М-ЭХО при УЗИ органов малого таза. УЗИ молочной железы выполняли через 6 мес. и 12 мес., через 12 мес. выполняли рентгеновскую маммографию.
Для анализа полученных данных применяли методы описательной статистики с вычислением средней арифметической и ее стандартной ошибки. Различия считались достоверными при р<0,05.
Результаты
У 38 обследованных (90,5%) из 42 с гиперплазией эндометрия были диагностированы доброкачественные заболевания молочных желез.
Основными клиническими проявлениями у обследованных являлись: масталгия — у всех пациенток, причем у 7 (16,7%) отмечалась выраженная интенсивность болевого синдрома, тогда как 30 (71,4%) и 5 (11,9%) из включенных в исследование имели умеренную и слабую интенсивность соответственно (рис. 1).
Выделения из сосков наблюдались у 5 (11,9%) пациенток и носили серозный характер. У данных пациенток было выполнено цитологическое исследование отделяемого. По результатам исследования атипических клеток не было обнаружено, цитограмма соответствовала картине фиброзно-кистозных изменений.
При выполнении УЗИ молочных желез было выявлено, что частота BI-RADS 2 у пациенток с ГЭ была в 9.5 раза выше, чем BI-RADS 1 (90,5% и 9,5% соответственно; р<0,05) (рис. 2).
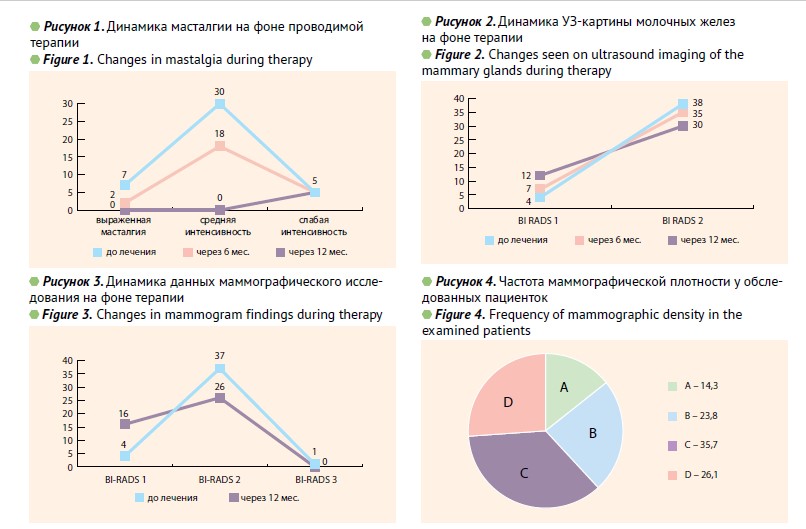
Как следует из данных маммографического исследования молочных желез (рис. 3), достоверно чаще у пациенток с ГЭ было заключение BI-RADS 2 (9,5% и 88% BI-RADS 1 и BI-RADS 2, соответственно; р<0,05). Пациентка с заключением маммографического исследования BI-RADS 3 была направлена на консультацию к онкологу. Пациентке была проведена cor-биопсия. В результате морфологического исследования – фиброз без гиперплазии эпителиальных структур, что дало основание оставить пациентку в исследовании.
Маммографическая плотность является собирательным понятием и определяется соотношением эпителиального и стромального компонентов, с одной стороны, и жирового — с другой. Повышенная маммографическая плотность является независимым фактором риска развития рака молочной железы [28–30]. В связи с этим решено было уделить данному показателю особое внимание. Маммографическая плотность (рис. 4) молочных желез среди обследованных распреде лилась следующим образом: АСR А была зафиксирована у 6 (14,3%), ACR B-10 (23.8%), ACR C и D-15 (35,7%) и 11 (26,1%), соответственно. Таким образом, повышенную маммографическую плотность имели 26 пациенток (61,8%).
В результате проведенной терапии через 6 мес. отмечался положительный клинический эффект (рис. 1): 25 (59,5%) пациенток отметили полное исчезновение болевого синдрома, у остальных частота масталгии уменьшилась в 1,68 раза по сравнению с показателем до начала лечения (на 40,48% через 6 мес. лечения, р<0,05).
Через 12 мес. терапии положительную динамику в клинической картине отметили все пациентки, включенные в исследование. Следует указать, что 5 пациенток с выраженной интенсивностью масталгии до лечения, у которых сохранялась данная симптоматика спустя 6 мес. лечения, отметили уменьшение интенсивности болевого синдрома через 12 мес. терапии.
Динамика выделений из сосков на фоне терапии изменялась следующим образом: через 6 мес. применения купировались у 2 (40%) пациенток, через 12 мес. – у 3 (60%).
Все пациентки были обследованы на уровень соотношения метаболитов эстрогена 2-ОНЕ1/16а-ОНЕ1. Отклонение от нормальных величин 2/1 были обнаружены у 27 (64,2%) пациенток. При оценке уровня соотношения метаболитов эстрогена 2-ОНЕ1/16а-ОНЕ1 было выявлено, что через 6 мес. терапии индол-3-карбинолом количество пациенток с отклонениями данного показателя от нормальных значений уменьшилось на 22% (n=21; 50%) (р>0,05), через 12 мес. на 92,9% (n=3; 7.14%) (р<0,05) по сравнению с показателями до начала лечения.
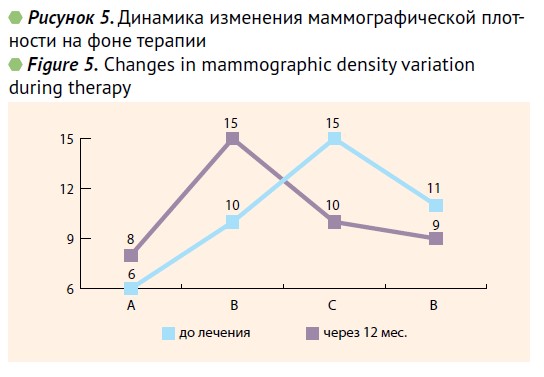
При контрольном обследовании 42 пациенток через 6 и 12 мес. после начала терапии обнаружен положительный эффект в ультразвуковой картине молочных желез. Из полученных данных (рис. 3), следует, что через 6 мес. терапии улучшение УЗ-картины по Bi-RADS произошло у 3 (7,1%) пациенток, после 12 мес. терапии еще у 5 (11,9%) обследованных. Всего улучшение УЗ-картины мы наблюдали у 8 (19%) пациенток (р<0,05).
При маммографическом исследовании через 12 мес. от начала терапии была выявлена положительная динамика, а именно улучшение категории BI-RADS было зафиксировано у 12 (28,5 %) пациенток (р<0,05). Улучшение показателей маммографической плотности по системе АСR через 12 мес. терапии наблюдались у 14 (33,3%) пациенток. Динамика изменения этих данных отражена на рис. 5.
При УЗИ органов малого таза не было данных свидетельствующих о рецидиве гиперплазии эндометрия.
На фоне терапии 3 пациентки отметили диспепсические явления на фоне приема препарата. Всем пациенткам было рекомендовано изменить время приема препарата (после приема пищи), что позволило купировать нежелательные явления и пациентки продолжили участие в исследовании.
Обсуждение
В данном исследовании была оценена эффективность применения индол-3-карбинола при сочетанной пролиферативной патологии молочных желез и эндометрия. Анализ результатов показал, что все пациентки с гиперплазией эндометрия имели доброкачественную дисплазию молочных желез. На фоне проводимой терапии индол-3-карбинолом наблюдалась положительная динамика. Через 6 мес. у 59,5% пациенток была купирована масталгия, количество пациенток с отклонениями ОНЕ1/16а-ОНЕ1 уменьшилось на 22%, улучшение УЗ-картины по Bi-RADS произошло у 7,1% пациенток. Через 12 мес. терапии выделения из сосков были купированы у всех пациенток, также у всех пациентов была положительная динамика по купированию болевого синдрома, количество пациенток с отклонениями ОНЕ1/16а-ОНЕ1 уменьшилось на 92,86% по сравнению с показателями до начала лечения, улучшение картины по Bi-RADS по данным УЗИ произошло у 19% пациенток, по данным маммографии у 28,5%, а улучшение показателей маммографической плотности по системе АСR наблюдались у 14 (33,3%) пациенток.
I3C является эффективным средством при гормональнозависимых доброкачественных заболеваниях молочных желез. Эффекты опосредованы его антипролиферативной активностью:
- стимулирование 2-гидроксилирования эстрадиола, что нормализует метаболизм эстрадиола и ингибирует синтез 16а-гидроксиэстрона, обладающего выраженными канцерогенными свойствами, индуцирование избирательного апоптоза в опухолевых и опухолеподобных клетках,
- ингибирование ростовых факторов, отвечающих за патологическую клеточную пролиферацию,
- ингибирование эстрогеновых рецепторов, снижая их количество на тканях-мишенях,
- ингибирование инвазии, ангиогенеза.
На сегодняшний день на фармацевтическом рынке появляется большое количество новых препаратов, содержащих I3C. В частности, заслуживает внимание новая БАД Имастон (АО «Аквион»), в состав 1 таблетки которой входит 200 мг индол-3-карбинола и 60 мг ресвератрола. Ресвератрол представляет собой мощный антиоксидант. Высокая концентрация ресвератрола содержится в красном винограде. Именно употреблением красного вина, богатого ресвератролом, объясняли феномен «французского парадокса», заключающийся в низкой распространенности сердечно-сосудистых и онкологических заболеваний во французской популяции [31]. Установлено несколько механизмов онкопротективного действия ресвератрола. К ним относятся фитоэстрогенные эффекты, up-регуляция SIRT1, ингибирование фактором некроза опухоли g-индуцированной NF-cВ-активности, ингибирование циклооксигеназы-2 и антиоксидантной активности, стимуляция апоптоза, регуляция пролиферации и снижение активности процессов ангиогенеза и метастазирования [32]. Экспериментальные исследования показали хорошую переносимость ресвератрола и отсутствие токсичных эффектов [33]. Ресвератрол не обладает генотоксичностью даже в высоких дозах до 200 мг/кг массы тела [27, 28], не вызывает эмбриотоксических и тератогенных эффектов [36].
Заключение
Результаты проведенного исследования продемонстрировали высокую частоту случаев сочетания гиперплазии эндометрия и доброкачественных гиперпластических процессов в молочной железе. Данный факт подтверждает общность механизмов формирования этих патологических состояний. Терапию индол-3-карбинолом можно оценить, как имеющую влияние на общие звенья патогенеза этих состояний и являющуюся эффективным и безопасным методом лечения сочетанной пролиферативной патологии эндометрия и молочных желез. Также целесообразно актуализировать применение комбинации индол-3-карбинола с антиоксидантом ресвератролом в клинической практике. Препараты, содержащие эти фитонутриенты, должны рассматриваться в будущих клинических исследованиях, как составляющая часть профилактики развития рака груди и гиперпластических процессов.
Список литературы:
- Черенков В.Г., Петров А.Б., Тверезовский С.А., Строженков М.М. От патогенеза опухолей молочных желез и гинекологических болезней к практическому решению проблемы. Российский онкологический журнал. 2014;19(5):47–51.
- Кравченко Е.Н., Ожерельева М.А. Состояние молочных желез при гинекологических заболеваниях (литературный обзор). Мать и дитя в Кузбассе. 2014;(2):19–23.
- Хашукоева А.З., Доброхотова Ю.Э., Ильина И.Ю., Дугиева М.З., Нариманова М.Р., Сухова Т.Н., Рощина В.А. Мастодиния и предменструальный синдром: есть ли взаимосвязь? Лечащий врач. 2015;(12):15–19.
- Радзинский В.Е. (ред.). Медицина молочной железы и гинекологические болезни. 2-е изд. М.: Status Praesens; 2017. 345 с.
- Ашрафян Л.А., Бабаева Н.А., Антонова И.Б., Алешикова О.И., Герфанова Е.В. Значение эстрогенных метаболитов в канцерогенезе опухолей женской репродуктивной системы. Медицинский оппонент. 2019;(3): 34–39.
- Ашрафян Л.А., Бабаева Н.А., Антонова И.Б., Овчинникова О.А., Алешикова О.И., Моцкобили Т.А., Кузнецов И.Н. Уровень баланса эстрогенных метаболитов при раке молочной железы и пути его коррекции. Опухоли женской репродуктивной системы. 2015;11(3):22–29.
- Ашрафян Л.А., Киселев В.И. Опухоли репродуктивных органов (этиология и патогенез). М.: Димитрейд График Групп; 2007. 217 c.
- Высоцкий М.М., Сазонова Е.О., Гараева Л.Р. Лечение фиброзно-кистозной мастопатии у пациенток после гистрэктомии. Вопросы гинекологии, акушерства и перинатологии. 2011;10(4):31–34
- Кулагина Н.В. Терапия фиброзно-кистозной болезни молочных желез у пациенток с миомой матки. Опухоли женской репродуктивной системы. 2010;(1):40–43.
- Доброхотова Ю.Э., Сапрыкина Л.В. Гиперплазия эндометрия. М.: ГЭОТАР-Медиа; 2019. 112 с.
- Доброхотова Ю.Э., Сапрыкина Л.В., Филатова Л.А., Нариманова М.Р. Аномальные маточные кровотечения: алгоритмы ведения, методы терапии. РМЖ. Мать и дитя. 2020;(1):55–60.
- Gianfredi V., Vannini S., Moretti M., Villarini M., Bragazzi N.L., Izzotti A., Nucci D. Sulforaphane and Epigallocatechin Gallate Restore Estrogen Receptor Expression by Modulating Epigenetic Events in the Breast Cancer Cell Line MDA-MB-231: A Systematic Review and Meta-Analysis. J Nutrigenet Nutrigenomics. 2017;10(3–4):126–135.
- Liu X., Lv K. Cruciferous Vegetables Intake Is Inversely Associated withRisk of Breast Cancer: A Meta-Analysis. Breast. 2013;22(3):309–313.
- Zhang N.Q., Ho S.C., Mo X.F., Lin F.Y., Huang W.Q., Luo H. et al. Glucosinolate and Isothiocyanate Intakes Are Inversely Associated with Breast Cancer Risk: A Case-Control Study in China. Br J Nutr. 2018;119(8):957–964.
- Берштейн Л.М. Гормональный канцерогнез. СПб.: Наука; 2000. 199 c.
- Mori M., Tominaga T., Tamaoki B.I. Steroid Metabolism in Normal Mammary Gland and in the Dimethylbenzanthracene-Induced Mammary Tumor of Rats. Endocrinology. 1978;102(5):1387–1397. doi: 10.1210/endo-102-5-1387.
- Wong G.Y., Bradlow L., Sepkovic D., Mehl S., Mailman J., Osborne M.P. Dose-Ranging Study of Indole-3-Carbinol for Breast Cancer Prevention. J Cell Biochem Suppl. 1997;28–29:111–116.
- Muti P., Bradlow H.L., Micheli A., Krogh V., Freudenheim J.L., Schünemann H.J. et al. Estrogen Metabolism and Risk of Breast Cancer: A Prospective Study of the 2:16alpha-Hydroxyestrone Ratio in Premenopausal and Postmenopausal Women. Epidemiology. 2000;11(6):635–640.
- Parl F.F., Dawling S., Roodi N., Crooke P.S. Estrogen Metabolism and Breast Cancer: A Risk Model. Ann N Y Acad Sci. 2009;1155:68–75.
- Ordi J., Bergeron C., Hardisson D., McCluggage W.G., Hollema H., Felix A. et al. Reproducibility of Current Classifications of Endometrial Endometrioid Glandular Proliferations: Further Evidence Supporting a Simplified Classification. Histopathology. 2014;64(2):284–292.
- Zaino R., Carinelli S.G., Ellenson L.H. et al. Tumours of the Uterine Corpus: Epithelial Tumours and Precursors. In: Kurman R.J., Carcanglu M.L., Herrington C.S., Young R.H. (eds.). WHO Classification of Tumours of Female Reproductive Organs. 4th ed. Lyon: WHO Press; 2014. рр. 125–126.
- Gallos I.D., Alazzam M., Clark T.J., Faraj R., Rosenthal A.N., Smith P.P., Gupta J.K. RCOG Management of Endometrial Hyperplasia. Green-Top Guideline No. 67. Royal College of Obstetricians and Gynaecologists; 2016.
- Katz E., Nisani S., Chamovitz D.A. Indole-3-Carbinol: A Plant Hormone Combatting Cancer. F1000Res. 2018;7:689–689.
- Bosetti C., Negri E., Kolonel L., Ron E., Franceschi S., Preston-Martin S.et al. A Pooled Analysis of Case-Control Studies of Thyroid Cancer. VII. Cruciferous and Other Vegetables (International). Cancer Causes Control. 2002;13(8):765–775.
- Rahman K.W., Aranha O.P., Sarkar F.H. Indole-3-Carbinol (I3C) Induces Apoptosis in Tumorigenic but not in Nontumorigenic Breast Epithelial Cells. Nutr Cancer. 2003;45(1):101–112.
- Aggarwal B.B., Ichikawa H. Molecular Targets and Anticancer Potential of Indole-3-Carbinol and Its Derivatives. Cell Cycle. 2005;4(9):1201–1215.
- Доброхотова Ю.Э., Юсупова Р.О., Озерова Р.И., Файзуллин Л.З., Карнаухов В.Н., Состояние рецепторного аппарата эндометрия и метаболизм эстрогенов при гиперплазиях эндометрия в позднем репродуктивном периоде. Вопросы гинекологии, акушерства и перинаталогии. 2009;8(3):52–58.
- Гарифуллова Ю. В. Лучевые методы диагностики доброкачественных заболеваний молочных желез. Практическая медицина. 2017;(7):51–56.
- D’Orsi C.J., Sickles E.A., Mendelson E.B., Morris E.A. et al. ACR BI-RADS® Atlas, Breast Imaging Reporting and Data System. 5th ed. Reston, VA, American College of Radiology; 2013. 696 p.
- Корженкова Г.П. Диагностическое значение категорий BI-RADS в ведении пациенток с доброкачественной патологией молочных желез. Опухоли женской репродуктивной системы. 2016;12(4):10–16.
- Vázquez-Agell M., Sacanella E., Tobias E., Monagas M., Antúnez E., Zamora-Ros R. et al. Inflammatory Markers of Atherosclerosis Are Decreased after Moderate Consumption of Cava (Sparkling Wine) in Men with Low Cardiovascular Risk. J Nutr. 2007;137(10):2279–2284.
- Успенская Ю.Б. Клинические эффекты ресвератрола (обзор литературы). Гинекология. 2014;16(5):96–100.
- Baur J.A., Pearson K.J., Price N.L., Jamieson H.A., Lerin C., Kalra A. et al. Resveratrol Improves Health and Survival of Mice on a High-Calorie Diet.Nature. 2006;444(7117):337–342. doi: 10.1038/nature05354.
- Elliott P.J., Walpole S., Morelli L., Lambert P.D., Lunsmann W., Westphal C.H., Lavu S. Resveratrol/SRT-501. Drugs Fut. 2009;34(4):291–295.
- Wang Z., Zou J., Huang Y., Cao K., Xu Y., Wu J.M. Effect of Resveratrol on Platelet Aggregation in vivo and in vitro. Chin Med J (Engl). 2002;115(3):378–380.
- Williams L.D., Burdock G.A., Edwards J.A., Beck M., Bausch J. Safety Studies Conducted on High-Purity Trans-Resveratrol in Experimental Animals. Food Chem Toxicol. 2009;47(9):2170–2182.
Источник изображений на данной странице – Shutterstock / Fotodom.
