Нашивочникова Н.А.1, Крупин В.Н.1, Леанович В.Е.2

1 ФГБОУ ВО «ПИМУ» Минздрава России, Нижний Новгород, Россия;
2 АО «Аквион», Москва, Россия
Введение. Метаболический синдром (МС) представляет собой совокупность гормональных, метаболических и клинических нарушений. Сегодня МС у мужчин рассматривается как один из ведущих факторов риска развития сердечно-сосудистых заболеваний, нарушений углеводного обмена, патологии репродуктивной системы.
Цель: изучить влияние комплекса фолиевой кислоты, L-карнитина, витамина Е, цинка и селена, входящих в состав биологически активной добавки (БАД) «Сперотон» на параметры углеводного и липидного обменов у мужчин с МС, особенно на ранних этапах его развития, а также на эректильную функцию и качество жизни пациентов.
Материалы и методы. В исследовании приняли участие 64 пациента в возрасте от 30 лет до 51 года с МС различной степени выраженности. Клиническую группу составили 34 пациента в возрасте от 32 лет до 51 года (средний возраст – 46,2±2,1 года), контрольную группу – 30 пациентов в возрасте от 30 до 49 лет (средний возраст – 45,4±3,4 года). Стандартная терапия пациентов клинической группы была дополнена приемом БАД «Сперотон» в течение 3 мес. Пациенты контрольной группы получали только стандартную терапию МС. Результаты оценивали через 3 и 6 мес. от начала приема БАД «Сперотон».
Всем пациентам выполнен лабораторный анализ половых гормонов, показателей углеводного обмена, липидного профиля. Кроме того, оценивали концентрацию цинка в спермоплазме, а также уровень общей антиокислительной активности (ОАА) спермы. Выполняли урофлоуметрию, ультразвуковое исследование (УЗИ) мочевого пузыря с определением объема остаточной мочи, трансректальное УЗИ простаты.
Результаты исследования. В результате включения в комплексное лечение МС антиоксидантного комплекса «Сперотон» в клинической группе практически в 2 раза снизились проявления окислительного стресса: к 6-му месяцу наблюдения уменьшилась концентрация ИРИ, что сопровождалось снижением уровня гликированного гемоглобина (HbA1c) на 16,3 %, свидетельствующим о стабилизации углеводного обмена. Положительная динамика в рамках снижения индекса массы тела (ИМТ) почти на 14% (p<0,05) в клинической группе сопровождалась нормализацией липидный профиля крови. Анализ состояния эректильной функции у пациентов контрольной группы спустя 6 мес. от начала терапии выявил снижение общего суммарного балла до умеренной степени эректильной дисфункции (12,5±2,1 балла). Отмечено снижение ирритативной симптоматики и частично – обструктивных симптомов у пациентов клинической группы на фоне антиоксидантной терапии. Кроме того, получены положительные корреляционные связи между концентрацией цинка и уровнем ОАА в эякуляте.
Выводы. Полученные результаты свидетельствуют о высокой терапевтической эффективности БАД «Сперотон» как антиоксидантного комплекса для лечения пациентов с МС различной степени выраженности. Включение антиоксидантов БАД «Сперотон» в комплексную терапию МС способствует эффективному восстановлению чувствительности инсулиновых рецепторов, нормализации углеводного и липидного обменов, эндотелиальной функции и АД, что сопровождается статистически значимым уменьшением проявлений СНМП, а также улучшением эректильной функции пациентов.
Ключевые слова: метаболический синдром, ожирение, андрогенный дефицит, окислительный стресс, антиоксиданты, инсулинорезистентность, Сперотон
Введение
Метаболический синдром (МС) – это сложный прогрессирующий процесс, включающий абдоминальное ожирение, инсулинорезистентность (ИР), гипергликемию, дислипидемию, артериальную гипертензию (АГ), нарушение системы гемостаза, хроническое субклиническое воспаление, повышение уровня мочевой кислоты [1].
В качестве потенциальных компонентов МС у мужчин также следует рассматривать такие нарушения мужской репродуктивной системы, как возрастной андрогенный дефицит и эректильная дисфункция (ЭД). Согласно современным исследованиям среди пациентов с МС ЭД встречается в 51,2% наблюдений, тогда как у 46,4% мужчин с ЭД встречаются отдельные компоненты МС [2]. В целом среди мужчин с ЭД основные факторы риска (АГ, гиперхолестеринемия, ИР и сахарный диабет [СД]) встречаются в 2 раза чаще по сравнению с мужчинами без ЭД [3]. Как показал ряд исследований [4–6], МС является фактором риска прогрессии не только ЭД, но и симптомов нижних мочевыводящих путей (СНМП), а в дальнейшем и гиперплазии предстательной железы.
Особую роль в развитии МС играет жировая ткань, чувствительная к действию инсулина и являющаяся одним из основных регуляторов метаболизма. Ее избыточное развитие за счет гиперплазии и/или гипертрофии составляющих ее клеток сначала приводит к развитию ожирения, а затем и к ИР. Что касается жировой ткани, то она представляет собой не просто пассивный «аккумулятор энергии», но и активный ауто-, пара- и эндокринный орган, способный синтезировать и секретировать в кровоток биологически активные соединения пептидной и непептидной природы, играющие важную роль в функционировании разных систем организма, в том числе сердечно-сосудистой. Адипоциты являются источником провоспалительных цитокинов: ФНОα, ингибитора активатора плазминогена 1, ИЛ-6, лептина, ангиотензиногена, инсулиноподобного фактора роста 1 и т.д. Согласно современным представлениям, прогрессирующее развитие ожирения и формирование метаболических осложнений являются результатом хронического воспаления жировой ткани и ее дисфункции как эндокринного и иммунологически активного органа [7].
Различные заболевания сердечно-сосудистой системы как компоненты МС на ранних этапах его развития являются следствием эндотелиальной дисфункции, вызванной активацией провоспалительного/протромботического состояния [7–9].
Согласно современным данным о функционировании клеток (в частности, эндотелия) разных органов, ведущую роль в развитии сердечно-сосудистых заболеваний (ССЗ) играет оксидативный стресс – избыточное образование активных форм кислорода (АФК) вследствие перекисного окисления липидов (ПОЛ) клеточной мембраны. Активные формы кислорода, имеющие неспаренный электрон, в зависимости от концентрации обусловливают прямо противоположные биологические эффекты: при нормальной концентрации – регуляторный, при избыточной – токсический [10, 11].
Дисфункция эндотелия связана в первую очередь с нарушением образования NO, обусловленным дефектом функций антиоксидантной системы под воздействием свобод- норадикального окисления, и является одним из ведущих звеньев в развитии ССЗ.
Оксидантная система в силу своей потенциальной опасности для клеточных структур в процессе эволюции способствовала формированию защитной системы – антиоксидантов, представленных ферментами и низкомолекулярными соединениями. Антиоксиданты либо непосредственно связывают свободные радикалы (прямые антиоксиданты), либо стимулируют антиоксидантную систему тканей (непрямые).
Наиболее известная молекула с антиоксидантным действием – карнитин – существует в формах: L-карнитин и ацетил-L-карнитин. L-карнитин, как известно, главный эндогенный кофактор транспорта длинноцепочечных β-жирных кислот в митохондриальный матрикс для их дальнейшей утилизации в процессе синтеза клеточной энергии (карнитиновый челночный механизм).
В литературе описаны кардиопротективный, нейропротективный, нефропротективный и гепатопротективный эффекты L-карнитина, отмечено его благоприятное влияние на углеводный, жировой и белковый обмены, что позволяет рассматривать препарат в качестве универсального регулятора метаболических процессов в организме у пациентов с МС и различными его проявлениями [12, 13].
L-карнитин участвует и регулирует многочисленные жизненно важные процессы, протекающие в организме человека [14, 15]. Способность L-карнитина утилизировать жирные кислоты в качестве субстрата для энергетического метаболизма широко используется в разных областях медицины, в частности для коррекции избыточной массы тела [16, 17], в комплексе мероприятий по увеличению мышечной массы в спортивной медицине [18, 19].
Экспериментальные исследования продемонстрировали, что систематическое применение L-карнитина обеспечивает стойкое снижение концентрации липидов в сыворотке крови, а также в паренхиме печени [20].
В аспекте ведения пациента с МС представляется актуальным не только кардиопротективный эффект и позитивное влияние L-карнитина на липидный спектр, но и влияние на уровень АД [21, 22].
Несомненный интерес представляют результаты исследований, посвященных влиянию карнитина на метаболизм глюкозы. Было показано, что его введение в организм больных СД обеспечивает повышение чувствительности к инсулину, соответственно, снижая резистентность к нему [23, 24]. Более того, было установлено, что регулярное потребление с пищей карнитина обеспечивает снижение концентрации глюкозы, определяемой в периферической крови натощак [25].
Витамин Е относится к группе α-токоферолов, способен улучшать иммунный статус, снижать риск развития атеросклероза, что косвенно свидетельствует о его положительной роли в улучшении качества жизни и ее продлении. Способность α-токоферолов ингибировать перекисное окисление липопротеинов низкой плотности (ЛПНП) дает основание предполагать их эффективность в профилактике ИБС, так как они подавляют атерогенез. Это предположение подтверждается данными 4 многоцентровых клинических исследований, посвященных изучению роли витамина Е в профилактике ССЗ [8, 26–28].
Фолиевая кислота – водорастворимый витамин, необходимый для роста и развития кровеносной и иммунной систем. Коферментные функции фолиевой кислоты непосредственно связаны с переносом одноуглеродных групп, первичными источниками которых в организме являются производные хорошо известных аминокислот (сери- на, глицина, метионина, холина, триптофана, гистидина), а также формальдегид, муравьиная кислота и метанол. Производные фолиевой кислоты играют исключительно важную роль в биосинтезе белков и нуклеиновых кислот, поэтому неудивительно, что при недостатке фолиевой кислоты нередко наблюдаются глубокие нарушения обмена. Фолиевая кислота обладает акцепторными свойствами по отношению к водороду, что определяет ее участие в окислительно-восстановительных процессах [29].
К модуляторам активности антиоксидантных ферментов может быть отнесен селен. Его действие связывают с участием в активации антиоксидантной системы посредством фермента глутатионпероксидазы, активным центром которого является селен, недостаток которого может приводить к снижению активности данного фермента. Селензависимыми ферментами являются тиоредоксинредуктаза и 5-дейодиназа. Помимо этого, селен входит в состав селенопротеинов Р и W, содержащихся в плазме [30]. Таким образом, с учетом важнейшей роли окислительного стресса в механизмах развития многих компонентов МС патогенетически обоснованным новым фармакотерапевтическим методом становится широкое применение антиоксидантов, особенно на ранних этапах его развития.
Цель исследования: изучение влияния комплекса фолиевой кислоты, L-карнитина, витамина Е, цинка и селена, входящего в состав БАД «Сперотон» («Аквион», Россия) на параметры углеводного и липидного обменов у мужчин с МС, особенно на ранних этапах его развития, а также на эректильную функцию, качество жизни пациентов.
Материалы и методы. В исследовании приняли участие 64 пациента в возрасте от 30 лет до 51 года с МС различной степени выраженности. При этом учитывались:
- степень ожирения и артериальной гипертензии;
- выраженность метаболических изменений;
- наличие или отсутствие сахарного диабета и заболеваний, связанных с атеросклерозом.
Было сформировано две группы пациентов, сопоставимые по возрасту и клинической картине заболевания. Клиническую группу составили 34 пациента в возрасте от 32 лет до 51 года (средний возраст – 46,2±2,1 года) с индексом массы тела (ИМТ) ≥25 кг/м2, у которых стандартная терапия (фенофибрат, сульфат магния, эксенатид, при необходимости метформин, бисопролол) была дополнена приемом БАД «Сперотон» в течение 3 мес. Компоненты БАД совместимы с препаратами базовой терапии. «Сперотон» рекомендовано принимать взрослым по 1 саше в день во время еды, растворив содержимое саше-пакетика в стакане воды (200–300 мл) комнатной температуры.
Группу контроля составили 30 пациентов в возрасте от 30 до 49 лет (средний возраст – 45,4±3,4 года), с ИМТ ≥25 кг/м2 с МС различной степени выраженности, которым проводилась только стандартная терапия.
Метаболический синдром у пациентов обеих групп диагностировали согласно рекомендациям международного консенсуса при наличии по крайней мере трех из следующих пяти признаков:
- центральное ожирение, подтвержденное объемом талии более 102 см;
- сниженный (менее 1,03 ммоль/л) уровень липопротеинов высокой плотности или нормальные показатели липидного обмена на фоне терапии по поводу дислипидемии;
- уровень триглицеридов в плазме крови более 1,7 ммоль/л.
- АГ (уровень систолического АД (САД) ≥130 мм рт.ст. и более и/или диастолического АД (ДАД) ≥85 мм рт. ст.) или нормальные показатели АД на фоне гипотензивной терапии.
- гликемия натощак ≥6,0 ммоль/л или нормальный уровень глюкозы на фоне сахаропонижающей терапии по поводу СД [31].
Результаты оценивали через 3 и 6 мес. от начала приема БАД «Сперотон».
Пациентам проводили объективное (физикальное) обследование (оценка ИМТ, АД) анкетирование по опросникам I-PSS (Международная система суммарной оценки заболеваний предстательной железы, СНМП), МИЭФ-5 (Международный индекс эректильной функции).
Лабораторная диагностика включала определение следующих показателей: биохимического профиля, тестостерона общего, простат-специфического антигена, альбумина, лютеинизирующего гормона, инсулина, глюкозы, гликированного гемоглобина, липидного профиля. Кроме того, у всех мужчин определяли концентрацию цинка в спермоплазме, а также уровень общей антиокислительной активности (ОАА) спермы.
Всем пациентам выполнены урофлоуметрия, УЗИ мочевого пузыря с определением объема остаточной мочи, трансректальное УЗИ простаты.
Критерии включения в исследование: верифицированный диагноз МС различной степени выраженности; подписанное информированное согласие на участие в программе; отсутствие мочевой инфекции, бактериального простатита и воспалительного синдрома хронической тазовой боли (класс IIIА по классификации Национального института здоровья США); нормальный уровень простатспецифического антигена.
Критерии невключения в исследование: наличие серьезных сопутствующих заболеваний (тяжелые аллергические реакции или анамнестические сведения о тяжелых нежелательных реакциях на лекарственные препараты, например отек Квинке; заболевания печени в активной стадии; почечная недостаточность по клиническим показателям; острые состояния; злоупотребление алкоголем; гиперчувствительность к компонентам препарата; злокачественные новообразования; наличие противопоказаний к применению БАД «Сперотон».
Достоверность различий определяли непараметрическим критерием Манна–Уитни, статистически значимыми считали различия при вероятности больше 95%.
Результаты
После включения в исследование пациентам обеих групп была рекомендована диета, направленная на снижение массы тела.
Нормальный уровень гликемии натощак обеспечивается гиперинсулинемией: уровень иммунореактивного инсулина (ИРИ) натощак в обеих группах был выше нормы почти в 5 раз (табл. 1). В то же время повышенный исходный уровень инсулина в крови является причиной повышенного АД у пациентов обеих групп: систолическое АД (САД) в среднем превысило нормальные показатели на 34,1%, диастолическое АД (ДАД) – на 30,1% (p<0,001).
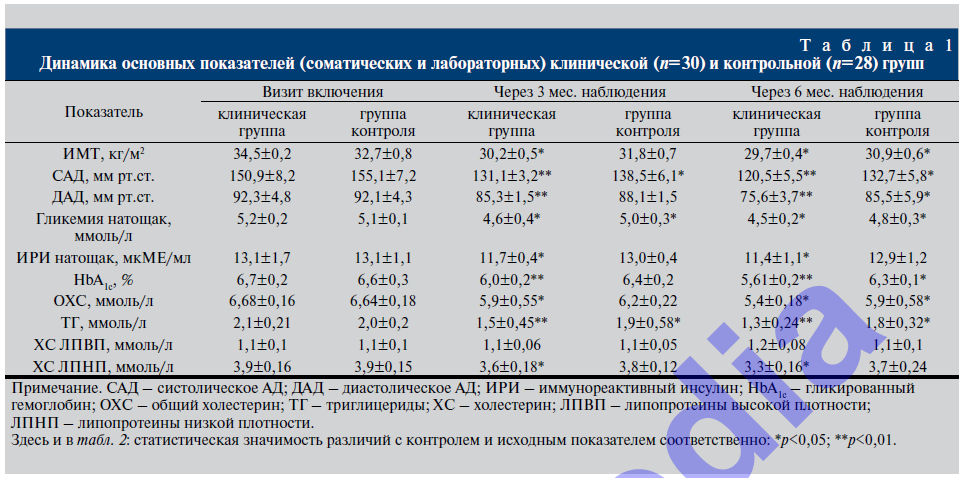
В результате включения в комплексное лечение МС антиоксидантного комплекса «Сперотон» в клинической группе практически в 2 раза снизились проявления окислительного стресса: через 6 мес. наблюдения уменьшилась концентрация ИРИ, что сопровождалось уменьшением уровня гликированного гемоглобина (HbA1c) на 16,3%, свидетельствующим о стабилизации углеводного обмена. При этом в группе контроля данный показатель снизился лишь на 4,5%. Положительная динамика (снижение) ИМТ почти на 14% (p<0,05) в клинической группе сопровождалась нор- мализацией липидного профиля крови: отмечено статистически значимое уменьшение концентрации триглицеридов ТГ на 38,1%, рост содержания холестерина липопротеинов высокой плотности (ХС ЛПВП) на 9,1% (соответственно р<0,001 и р<0,05). В группе контроля ИМТ снизился лишь на 5,5%, уровень общего холестерина (ОХС) крови уменьшился на 11,14%, при этом холестериновые фракции статистически значимо не изменились.
Более выраженная положительная динамика показателей АД у пациентов клинической группы по сравнению с группой контроля после лечения (снижение САД и ДАД за 6 мес. наблюдения соответственно на 20,1 и 18,1%), вероятнее всего, объясняется снижением активности симпатико-адреналовой системы в результате восстановления чувствительности инсулиновых рецепторов на фоне снижения влияния окислительного стресса, о чем свидетельствует уменьшение компенсаторной гиперинсулинемии почти на 13%. В контрольной группе показатели ИРИ крови статистически значимо не изменились.
Согласно оценке эректильной функции пациентов обеих групп, до лечения суммарный балл по шкале МИЭФ-5 находился в интервале от 5,4±2,1 до 15,5±3,1, что свидетельствует о наличии умеренной и выраженной ЭД. Анализ состояния эректильной функции у пациентов группы контроля спустя 6 мес. от начала терапии выявил снижение общего суммарного балла до 12,5±2,1 (умеренная степень ЭД). Мужчины клинической группы имели статистически значимо более высокие показатели спустя 6 мес. от начала комплексной терапии: суммарный балл по шкале МИЭФ-5 соответствовал легкой ЭД (18,1±2,3; p<0,05). Важно отметить, что пациенты обеих групп на протяжении всего периода терапии и наблюдения не получали ингибиторы ФДЭ-5.
Признаки биохимического гипогонадизма были выявлены у 13 человек клинической группы и у 10 человек группы контроля. Гормонозаместительную терапию пациентам в обеих группах не проводили. На фоне проводимого лечения в группе контроля признаки биохимического гипогонадизма сохранились у 8 человек – уровень общего тестостерона составил 9,8±1,2 нмоль/л, что ниже аналогичного показа- теля в клинической группе – 13,4±2,1 нмоль/л (р<0,05), в которой признаки сниженного уровня тестостерона сохранились у 7 человек.
При анализе анкет I-PSS было выявлено, что до начала терапии пациенты обеих групп имели умеренные нарушения микции (17,5±2,0 балла). Однако по прошествии 6 мес. от начала терапии суммарный балл у пациентов группы контроля имел градацию умеренных нарушений, составив 13,5±2,0 балла, и был статистически значимо выше, чем в клинической группе, где данный показатель находился на границе оценок легкой и умеренной симптоматики – 8,4±1,5 балла (р<0,01). При сопоставлении ответов на вопросы, входящие в раздел симптомов накопления (ирритации) и опорожнения (обструкции), обращало внимание превалирование ирритативной симптоматики у пациентов группы контроля и равномерное распределение в клинической группе пациентов. При этом пациенты обеих групп не получали α-адреноблокаторы на протяжении всего исследования. Наличием СНМП различной степени выраженности прежде всего и объясняется негативное отношение к своему состоянию и, соответственно, более низкую оценку качества жизни пациентов группы контроля. Среднее значение индекса QoL в этой группе составило 4,3±0,8 балла, тогда как в клинической группе этот показатель не превысил 2,1±0,6 балла (р<0,05) после 6 мес. терапии. Исходный балл до начала лечения в клинической группе составил 4,2±0,3 балла, в группе контроля – 4,1±0,4 балла.
Различия в выраженности СНМП в обеих группах наблюдения можно объяснить снижением ирритативной симптоматики и частично обструктивных симптомов у пациентов клинической группы на фоне антиоксидантной терапии.
Таким образом, комплекс биологически активных веществ, входящих в состав БАД «Сперотон», способен влиять на параметры углеводного и липидного обменов у пациентов с МС, особенно на ранних этапах его развития, достоверно снижать выраженность СНМП, а также положительно влияет на эректильную функцию пациентов.
Доказано, что у пациентов с МС регистрируется максимальный дефицит факторов антиоксидантной системы защиты (АОСЗ), МС достоверно ассоциируется со снижением концентрации некоторых кофакторов ключевых ферментов АОСЗ в секрете предстательной железы, в частности цинка – доказанного и эффективного антиоксиданта [32]. Эти процессы достаточно быстро способны приводить к декомпенсации естественной системы антиоксидантной защиты клеток мужской половой системы. В результате нарушается нормальное функционирование клеточных структур, клетки теряют способность к репарации и физиологическому апоптозу.
С учетом того, что цинк также играет важную роль в механизмах регуляции мужской репродуктивной системы, у всех мужчин была определена его концентрация в спермоплазме, а также уровень ОАА спермы. Исследование выявило выраженное исходное снижение обоих показателей у всех пациентов с МС (табл. 2).

Были отмечены статистически значимые различия на разных этапах лечения и наблюдения пациентов в показателях концентрации цинка в обеих группах (р<0,001).
Обсуждение. Метаболические нарушения являются доминирующими факторами риска в развитии ССЗ и их осложнений среди мужчин трудоспособного возраста, что приводит к ухудшению качества жизни и снижению ее продолжительности. Как показывают данные клинических исследований, между МС, ЭД и андрогенодефицитным состоянием имеется тесная патогенетическая связь, что необходимо учитывать при диагностике и подборе профилактических мероприятий. Очевидно, что при наличии у пациента нескольких нарушений необходимо применение комплексного подхода к диагностике и подбору медикаментозной коррекции.
Эндотелиальная дисфункция и как следствие – ишемия и системное воспаление являются неотъемлемой частью патогенеза МС. Ориентируясь на результаты проведенного исследования и данные литературы, можно сказать, что МС выступает причиной СНМП. По сути СНМП могут быть следствием системного воспаления, ассоциированного с МС, или ишемии детрузора в связи с дефицитом оксида азота на фоне приобретенного гипогонадизма [33–35].
Независимо от выраженности проявлений МС важную роль, особенно на ранних стадиях заболевания, играет окислительный стресс. Он негативно сказывается на метаболическом равновесии клеток мужской половой системы, усиливая функциональные нарушения, что провоцирует возникновение и дальнейшее прогрессирование СНМП у пациентов с МС.
Нарушения углеводного и липидного обменов при МС, особенно на ранних этапах его развития, также следует рассматривать как следствие окислительного стресса, который в свою очередь способствует развитию ИР, формированию избыточной массы жировой ткани.
Сегодня, когда доказана роль механизмов окислительного стресса при любой форме МС, следует как можно активнее внедрять в рутинную клиническую практику методы оценки оксидативного статуса пациентов в целом и половой системы в частности, шире применять антиоксидантное сопровождение фармакотерапии заболевания.
Согласно результатам нашего исследования, применение в комплексной терапии МС, особенно на ранних этапах его развития, естественных антиоксидантов, входящих в состав БАД «Сперотон», способствует эффективному восстановлению чувствительности инсулиновых рецепторов, нормализации углеводного и липидного обменов, эндотелиальной функции и АД. Использование антиоксидантной терапии в комплексном лечении пациентов с МС сопровождается статистически значимым уменьшением или полным исчезновением СНМП (результаты опросников I-PSS). Полученные данные свидетельствуют о высокой общей терапевтической эффективности комплексной терапии с использованием БАД «Сперотон» в течение 6 мес.
Полученные положительные результаты в отношении эректильной функции пациентов клинической группы на фоне терапии с использованием антиоксидантного комплекса «Сперотон» можно объяснить системным улучшением состояния эндотелия сосудов, стабилизацией гормонального фона пациента.
Нужно констатировать тот факт, что пока антиоксидантная терапия недостаточно широко используется при лечении пациентов с МС. Однако именно антиоксиданты, по нашему мнению, обеспечивают нормальный физиологический уровень протекания всех окислительно-восстановительных процессов в клетке, что позволяет эффективно управлять ключевыми звеньями негативного влияния окислительного стресса на органы и ткани при МС. С учетом выявленной ранее корреляционной зависимости между концентрацией цинка и уровнем общей антиоксидантной активности в эякуляте [36] определение концентрации цинка в спермоплазме и ее ОАА, особенно у молодых пациентов, страдающих МС, и назначение препаратов с целью коррекции дефицита цинка, является оправданным.
Таким образом, применение антиоксидантов, входящих в состав БАД «Сперотон» в комплексной терапии пациентов с МС, ассоциированного с нарушением липидного, углеводного обменов, сопутствующими СНМП, ЭД становится патогенетически весьма обоснованным.
Выводы
- Полученные результаты свидетельствуют о высокой терапевтической эффективности БАД «Сперотон» как антиоксидантного комплекса для лечения пациентов с МС различной степени выраженности.
- Определение концентрации цинка в спермоплазме и ее ОАА, особенно у молодых пациентов, страдающих МС, и назначение препаратов на его основе с целью коррекции дефицита цинка являются оправданными.
- Включение антиоксидантов БАД «Сперотон» в комплексную терапию МС способствует эффективному восстановлению чувствительности инсулиновых рецепторов, нормализации углеводного и липидного обменов, эндотелиальной функции и АД, что сопровождается статистически значимым уменьшением проявлений СНМП, а также улучшением эректильной функции пациентов.
Литература
- Серебренникова С.Н., Гузовская Е.В., Семинский И.Ж. Патофизиология метаболического синдрома: учебное пособие. ФГБОУ ВО ИГМУ Минздрава России, Кафедра патологической физиологии с курсом клинической иммунологии. Иркутск: ИГМУ,2016. С. 54.
- Борисов В.В., Демерза Ю.А. Особенности лечения больных эректильной дисфункцией. Лечащий врач. 2005;10: 86–89.
- Мамедов М.Н., Перова Н.В., Метельская В.А., Оганов Р.Г. Кардиология. М., 1999. С. 18–22.
- Vignozzi L., Morelli A., Sarchielli E., Comeglio P., Filippi S., Cellai I.,Maneschi E. et al. Testosterone protects from metabolic syndrome- associated prostate inflammation: an experimental study in rabbit. J Endocrinol. 2012; 212(1):71–84. Doi: 10.1530/JOE-11-0289.
- Братчиков О.И., Тюзиков И.А., Шумакова Е.А., Артищев С.О. Симптомы со стороны нижних мочевых путей, вызванные аденомой предстательной железы: результаты лечения в зависимости от андрогенного статуса. Андрология и генитальная хирургия. 2018;19(1):51–58. Doi: 10.17650/2070-9781-2018-19-1-51-58.
- Тюзиков И.А. Патогенетические механизмы влияния дефицита тестостерона на симптомы нижних мочевых путей у мужчин. Эффективная фармакотерапия. 2020;16(20):32–42. Doi: 10.33978/2307-3586-2020-16-20- 32-42.
- Маколкин В.И. Метаболический синдром. М.: МИА, 2010. С. 3–143.
- Аронов Д.М. Что важно знать практикующему врачу об убихиноне. Антиоксидантный препарат Кудесан. М.: Медпрактика. 2006;2:4–20.
- Дедов И.И., Балаболкин М.И., Мамаева Г.Г. и др. Антиоксидантная терапия диабета и его поздних осложнений. Пособие для врачей. М., 2001. С. 24–27.
- Ланкин В.З., Тихазе А.К., Беленков Ю.Н. Антиоксиданты в комплексной терапии атеросклероза: pro et contra. Пособие для врачей. М.: Медпрактика. 2006. С. 3–39.
- Mortensen S. Overview on coenzyme Q10 as adjunctive therapy in chronic heart failure. Rationale, design and end-points of Q-symbio-a multinational trial Biofactors. 2003;18(1–4):79–89.
- Трухан Д.И. Роль и место L-карнитина в цитопротекции и коррекции метаболических процессов у пациентов с метаболическим синдромом. Медицинский совет. 2017;12:182–187.
- Асташкин Е.И., Глезер М.Г. Роль L-карнитина в энергетическом обмене кардиомиоцитов и лечении заболеваний сердечно- сосудистой системы. Кардиология и сердечно-сосудистая хирургия. 2012;5(6):58–65.
- Lohninger A., Pittner G., Pittner F. L-Carnitine: New Aspects of a Known Compound – A Brief Survey. Monatsh. Chem. 2005;136(8):1255–1268.
- Surai P.F. Antioxidant action of carnitine: molecular mechanisms and practical applications. EC Veterinary Science. 2015;2(1):66–84.
- Ключников С.О. Перспективы применения L-карнитина в педиатрии. Consilium Medicum. 2007;2:116–119.
- Маркелова И.А., Балыкова Л.А. и др. Применение метаболической терапии для оптимизации толерантности юных спортсменов к физическим нагрузкам. Педиатрия. 2008;4:51–55.
- Балыкова Л. А., Солдатов О. М., Ивянский Л. А., Ферапонтова О. В. Обоснование использования L-карнитина в спортивной медицине. Российский вестник перинатологии и педиатрии. 2010;5:90–97.
- Ивянский С.А., Солдатов О.М., Щёкина Н.В. и др. Новые аспекты применения L-карнитина в спортивной практике. Ульяновский медико-биологический журнал.2012;3:97–103.
- Sachan D.S., Yatim A.M. Suppression of aflatoxin B1-induced lipid abnormalities and macromolecule-adduct formation by L-carnitine. J Environ Pathol Toxicol Oncol. 1992;11:205–210.
- Балыкова Л.А., Ивянский С., Широкова А. и др. Оценка уровня артериального давления у детей, привлеченных к регулярным занятиям спортом. Педиатрия. Журнал им. Г.Н. Сперанского. 2015;6:113–119.
- Сычева Ю.А., Горбачева И.А., Орехова Л.Ю. Применение метаболической терапии у полиморбидных больных с воспалительными заболеваниями пародонта на фоне гипертонической болезни. Пародонтология. 2016;2(79):39–42.
- Xu Y., Jiang W., Chen G. et al. L-carnitine treatment of insulin resistance: A systematic review and meta-analysis. Adv Clin Exp Med. 2017;26(2):333– 338.
- Mingrone G. Carnitine in type 2 diabetes. Ann N Y Acad Sci. 2004;1033:99– 107.
- Rahbar A.R., Shakerhosseini R., Saadat N. et al. Effect of L-carnitine on plasma glycemic andlipidemic profile in patients with type II diabetes mellitus. Eur J Clin Nutr. 2005;59:592–596.
- Капелько В.И. Активные формы кислорода, антиоксиданты и профилактика заболеваний сердца. РМЖ. 2003;11(21):1185–1188.
- Adarsh K., Kaur H., Mohan V. Coenzyme Q10 (CoQ10) in isolated diastolic heart failure in hypertrophic cardiomyopathy (HCM). BioFactors (Oxford, England). 2008;32(1–4):145–149.
- Mortensen S. Overview on coenzyme Q10 as adjunctive therapy in chronic heart failure. Rationale, design and end-points of Q-symbio-a multinational trial Biofactors. 2003;18(1–4):79–89.
- Ших Е.В., Махова А.А. Витамины в клинической практике. М.: Практическая медицина, 2014.\
- Tato Rocha R.E., Cárdenas Viedma E., Herrero Huerta E. Selenium: the physiopathological and clinical implications. An. Med. Interna. 1994;11(9):457–463.
- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive summary of the third report of The National Cholesterol Education Program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (adult treatment panel III). Journal of the American Medical Association. 2001;285:2486–2497.
- Condorelli R.A., Russo G.I., Calogero A.E. et al. Chronic prostatitis and its detrimental impact on sperm parameters: a systematic review and meta- analysis. J. Endocrinol. Invest. 2017;40(11):1209–1218.
- Huang M.Y., Wang M.Y., Lin Y.S., Lin C.J., Lo K., Chang I.J., Cheng T.Y. et al. The Association between Metabolically Healthy Obesity, Cardiovascular Disease, and All-Cause Mortality Risk in Asia: A Systematic Review and Meta-Analysis. Int J Environ Res Public Health. 2020; 17(4):1320. Doi: 10.3390/ijerph17041320.
- Yassin A.A., Nettleship J.E., Almehmadi Y., Yassin D.J., El Douaihy Y., Saad F. Is there a relationship between the severity of erectile dysfunction and the comorbidity profile in men with late onset hypogonadism? Arab J Urol. 2015;13(3):162–68. Doi: 10.1016/j.aju.2015.06.003.
- Shkodkin S., Idashkin Y., Shaderkin I., Shaderkina V., Polishchuk A., Chirkov S. Transurethral resection of benign prostatic hyperplasia and impaired miccia. J. Experimental and clinical Urology. 2017;(2):68–72. (in Russ.).
- Братчиков О.И., Дубонос П.А., Тюзиков И.А. Особенности обмена цинка и его связь с оксидативным статусом предстательной железы у здоровых мужчин и больных хроническим бактериальным простатитом. Эффективная фармакотерапия. 2021;17(17):6–14.
Источник изображений на данной странице – Shutterstock / Fotodom.
