Евдокимов В.В., Жуков О.Б., Шугушева Л.Х., Брагина Е.Е., Жуков А.А.

Введение
Бесплодие – это отсутствие беременности в течение года при регулярной половой жизни без использования противозачаточных средств. По статистике в России около 17% браков являются бесплодными, т. е. каждая шестая супружеская пара имеет проблемы с зачатием в тот или иной период своего репродуктивного возраста [1]. Проблема бесплодия в паре рассматривалась урологами и гинекологами обособленно друг от друга. В связи с чем восстановление сперматогенеза у мужчин и возможности зачатия у их партнерш не всегда приводят к реализации репродуктивной функции [2]. С нашей точки зрения, проблему бесплодия в паре целесообразно решать совместно специалистам двух смежных специальностей. Этому процессу стал активно помогать комплекс новых препаратов Спематон и Прегнотон. Они создают благоприятные условия для наступления маточной беременности при формирующемся бесплодии. Уникальность этого комплекса состоит в том, что он разработан для совместной подготовки обоих партнеров к реализации репродуктивной функции. Компоненты Спематона стимулируют сперматогенез, повышая концентрацию и увеличивая подвижность сперматозоидов в эякуляте. Прегнотон восполняет недостаток витаминов и минералов, необходимых для подготовки женского организма к зачатию и сохранению беременности. Компоненты Прегнотона нормализуют менструальный цикл, улучшают кровоснабжение в органах малого таза, создавая оптимальные условия для наступления беременности. Важно отметить, что Прегнотон не является гормональным препаратом и нормализует менструальный цикл за счет входящего в его состав растительного экстракта витекса [3, 4]. Лечение обоих партнеров в бесплодной паре при наличии показаний и их информированность о том, что каждый проходит курс терапии, улучшающий их репродуктивные возможности, положительно сказываются на доверительных отношениях друг к другу и дополнительно мотивируют к реализации репродуктивной функции.
Целью нашего исследования явилось изучение влияния препаратов Спематон и Прегнотон на реализацию репродуктивной функции в исследуемых парах.
Материалы и методы
В исследование были включены 50 семейных пар, планирующих зачатие: 25 пар с мужским фактором бесплодия секреторного типа (1-я группа), 25 пар с бесплодием, обусловленным варикоцеле в послеоперационном периоде (2-я группа). Сроки бесплодия в парах колебались от 1 до 4,5 года и в среднем достигали 2,8±1,6 года.
Спематон принимали мужчины в возрасте 20–45 лет с секреторной формой бесплодия и отсутствием беременности партнерши в браке (более 12 мес половой жизни без контрацепции). Критериями исключения были обтурационная форма бесплодия, наличие женского бесплодия у партнерши (непроходимость маточных труб, нарушения овуляции, распространенный эндометриоз и др.), алкогольная или наркотическая зависимость, повышенная чувствительность к любому из компонентов препарата, нарушения функции печени и почек, участие в другом клиническом исследовании в последние 3 мес.
Пациенты 1-й группы получали по 1 саше-пакету препарата Спематон в день в течение 3 мес, пациенты 2-й группы – по 2 саше-пакета в день в течение 3 мес. Активный период наблюдения составил 3 мес и включал в себя контрольные исследования на 1 и 90-й дни терапии. Всем пациентам на 1 и 90-й дни терапии проводились клинико-лабораторная диагностика, 3D–4Dультразвуковая ангиография яичка и придатка, трансректальное ультразвуковое исследование, спермограмма, определение антиспермальных антител (АСАТ), определялся уровень гормонов (пролактин, тестостерон, лютеинизирующий – и фолликулостимулирующий гормоны – ЛГ и ФСГ). Всем больным с патозооспермией проводилась ультразвуковая эластография яичка и придатка. Исследования выполняли на ультразвуковых приборах, Acuson S-3000, компании «Сименс». Общий период наблюдения обследуемой группы составил до 12 мес. Половые гормоны исследовались на иммунохемилюминисцентном анализаторе Ассess 2, производства Beckman Coulter, США. Биохимические исследования микронутриентов проводились на анализаторе Advia-1200.
Оценка АСАТ проходила в виде МАР-теста (MAR-test) – смешанная реакция иммуноглобулинов.
Для женщин критериями включения являлись: возраст 20–40 лет, период подготовки к беременности, отсутствие беременности, отсутствие инфекций репродуктивного тракта, отсутствие выраженной соматической патологии, отмена в течение 3 мес и более, предшествующих проводимому обследованию, гормонотерапии и других медикаментов, влияющих на уровень половых стероидов и пролактина, отсутствие сопутствующей эндокринной патологии (нарушения функции щитовидной железы), исключение рака молочной железы, эндометрия или других гормонозависимых опухолей.
Критериями исключения являлись наличие бесплодия (непроходимость маточных труб, нарушения овуляции, распространенный эндометриоз и др.), за исключением бесплодия, вызванного недостаточностью лютеиновой фазы, беременность и лактация, возраст младше 20 и старше 40 лет, алкогольная или наркотическая зависимость, повышенная чувствительность к любому из компонентов препарата, нарушения функции печени и почек, заболевания эндокринной системы, прием препаратов, влияющих на уровень пролактина в течение последних 3 мес, наличие герпетической инфекции в острой стадии, участие в другом клиническом исследовании в последние 3 мес.
В 1-ю группу вошли пациентки с относительной гиперпролактинемией, во 2-ю – 25 соматически здоровых пациенток. Прегнотон принимался пациентками обеих групп по 1 саше-пакету 1 раз в день в течении 3 мес. Для включенных в исследование женщин активный период наблюдения составил 3 мес.
Результаты
Исследование проведено у мужчин 20–44 лет (средний возраст составил 31,5±6,5 года), 1-ю группу мужчин составили 25 больных с секреторным бесплодием и назначенной терапией по 1 саше-пакетику Спематона в сутки (средний возраст 31,4±4,7 года). Во 2-ю группу включены 25 мужчин после операций по поводу варикоцеле (средний возраст 2-й группы 30,4±4,9 года ); табл. 1, 2.
Партнерш этих больных распределили на 2 группы: в 1-ю группу вошли 25 женщин (средний возраст 27,4±6,1 года) с относительной гипепролактинимией; во 2-ю группу были включены 25 соматически здоровых женщин (средний возраст 26,1±3,4 года, табл. 3).
Средняя продолжительность бесплодия в группах составила: 1-я группа – 4,2±3,7 года, 2-я группа 5,1±4,7 года.
Всего оперировано 25 пациентов с варикоцеле: 4 больных с субклинической стадией варикоцеле, 6 больных – с I стадией, 12 – со II стадией, 3 – с III. Операция проведена с двух сторон 3 больным. Из 25 больных 3 пациентам произведена операция Мармара слева, 22 больным проведена эндоваскулярная склеротерапия тестикулярных вен этоксисклеролом 3%, двум из них интраоперационно использовались рентгенозащитные накладки для яичек.
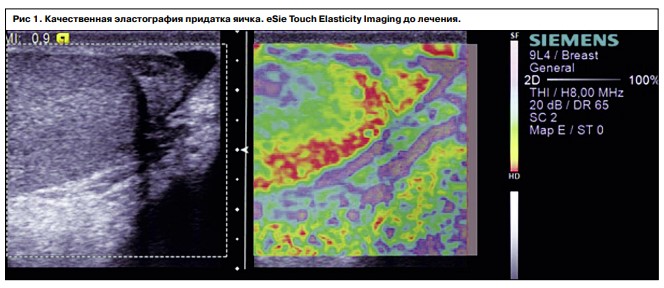
В ходе обследования соноэластография яичек и придатка была выполнена у всех мужчин, участвующих в исследовании, и была этапом ультразвукового комплексного исследования органов мошонки. Снижение эластичности ткани с наличием очагов повышенной плотности придатка яичка были выявлены у 34 пациентов (14 больных 1-й группы и 20 больных 2-й группы), участки сниженной эхогенности неоднородной структуры обнаружены у 12 пациентов 2-й группы. В режиме энергетического и цветового допплеровского картирования в данных зонах отмечалось обеднение сосудистого рисунка и снижение индекса перфузии. Применение ультразвуковой эластографии придатка яичка у больных с секреторным бесплодием и варикоцеле обусловлено тем, что высокая плотность придатка яичка у этих больных зачастую коррелирует с низким уровнем карнитина, обусловливающим снижение фертильности эякулята.
Через 3 мес контрольное исследование показало, что в группах больных с варикоцеле происходит снижение коэффициентов эластичности ткани в среднем в 1,6 раза по сравнению с исходными данными. В группе с секреторным бесплодием аналогичные изменения происходили медленнее. При ультразвуковой эластографии мошонки в обеих группах больных выявлено, что уменьшается площадь картирования плотных участков в среднем на 42% от исходной, что коррелировало с улучшением сперматогенеза (рис. 1, 2).
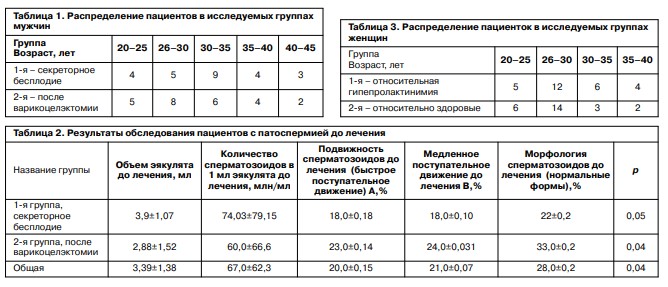
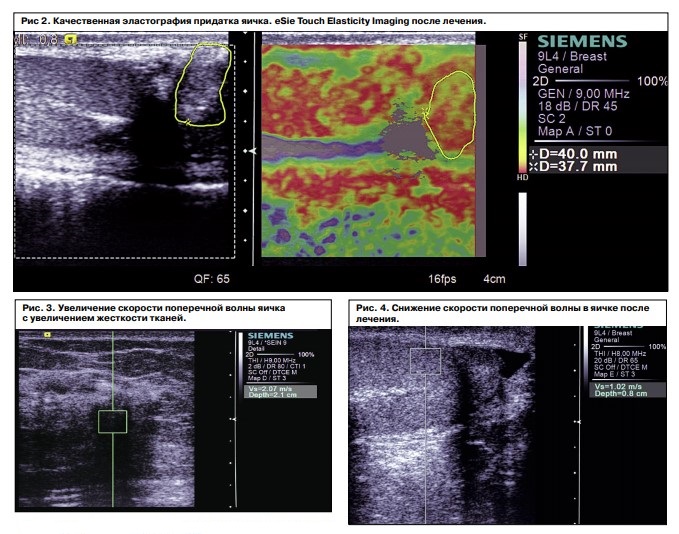
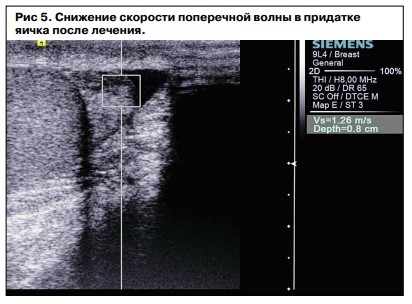
Данные наблюдения были подтверждены с помощью ARFI-Virtual Touch Tissue imaging, по данным которой качественная визуализация степени смещения ткани придатка и самого яичка стали меньше после лечения, что указывало на косвенные структурные изменения данной ткани с уменьшением ее плотности (рис. 3–5). При этом Vs – скорость поперечной волны – снизилась с 2,07 до 1,26 м/с.
По результатам сравнительного анализа данных спермограмм выявлено, что объем эякулята после лечения в среднем увеличился на 11,4%, в большей степени за счет 1-й группы больных. Концентрация сперматозоидов в 1 мл возросла на 32,5% в 1-й группе и на 25% – во 2-й. Быстрая подвижность сперматозоидов (А) выросла в 1-й группе на 100%, а во 2-й – на 62%, медленное поступательное движение сперматозоидов уменьшилось в 1-й группе на 34%, во 2-й – на 18% (p < 0,05). Прирост вычислялся по формуле:
[(х1-х2)/х2]*100%,
где х1 – достигнутый результат, х2 – исходный показатель.
Изменения в спермограммах (табл. 4) после лечения послужили причиной проведения уточняющего эксперимента, связанного с непосредственным влиянием Спематона на подвижность сперматозоидов in vitro.
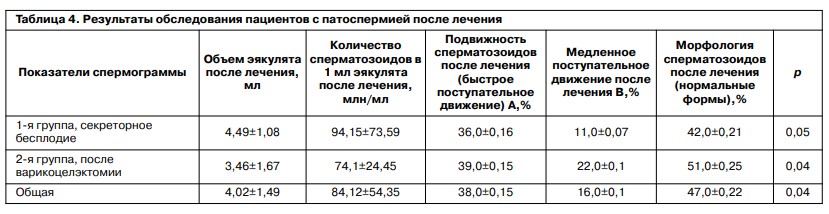
Был использован препарат в концентрации 100 и 1000 мкг/мл. Результаты представлены в табл. 5. Установлена прямая зависимость эффекта от концентрации добавленного препарата. Максимальный эффект проявился через 1 ч инкубации с некоторым снижением к 3-му часу наблюдения во фракции активноподвижных сперматозоидов.
Поскольку Спематон содержит L-карнитин, обладающий антиоксидантным действием, полученные результаты можно сравнить с другими препаратами, также содержащими антиоксиданты. Ранее были проведены опыты с препаратом Оводорин, содержащим экстракт мицелия гриба вешенки. В эякулят вносили препарат в разной концентрации (30 и 60 мкг/мл). Общая подвижность сперматозоидов через 3 ч повысилась на 104–107% по отношению к исходному уровню 100%.
Другой препарат, обладающий антиоксидантным свойством, также изученный нами ранее, – Мексидол. Препарат вносили в 2 разных концентрациях (50 и 500 мкг/мл). Была обнаружена зависимость эффекта от концентрации препарата. Общая подвижность сперматозоидов при добавлении малой концентрации препарата через 3 ч инкубации с эякулятом повысилась на 104–109%, высокая концентрация препарата повышала подвижность сперматозоидов в те же сроки на 116–120%.
Таким образом, Спематон в сравнении с другими антиоксидантными препаратами в эксперименте обладает более высоким положительным эффектом в отношении подвижности сперматозоидов, что позволяет рекомендовать его в терапии мужской патоспермии, связанной с падением подвижности – астенозооспермии [5].
Несоответствие между дозозависимыми данными эксперимента и отсутствием выраженного клинического эффекта при приеме 2 саше-пакетиков связаны, вероятно, с распадом составляющих в агрессивной среде желудочно-кишечного тракта, возможностью усвоения только определенного количества L-карнитина.
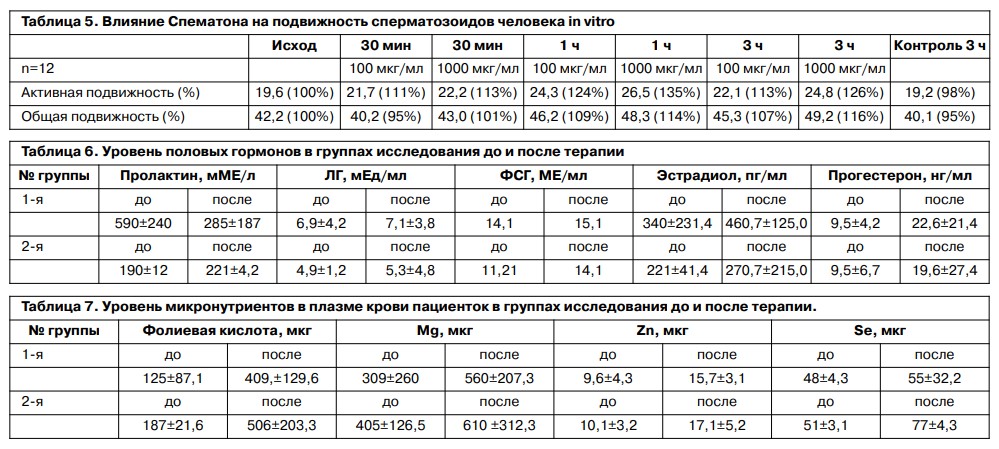
Другим подтверждением влияния Спематона на улучшение подвижности сперматозоидов в эякуляте послужили исследования электронной микроскопии сперматозоидов до и после лечения. При данном исследовании на фоне антиоксидантной терапии выявлены следующие признаки нормализации мембраны акросомы: уменьшение вакуолизации и уменьшение фрагментации хроматина [6]; рис. 6, 7.
С целью изучения взаимосвязи между относительной гиперпролактинемией и гормональной функцией яичников и бесплодием проведено обследование 25 женщин. Из них 21 имели разные формы и типы овариальной недостаточности. У 19 из них содержание пролактина в крови превышало 190 мМЕ/л и у 6 женщин уровень пролактина колебался от 530 до 600 мМЕ/л.
Вторую группу составили 25 здоровых женщин с регулярным менструальным циклом, содержание пролактина в крови которых было в пределах физиологических колебаний (170–200 МЕ/л).
Возраст наступления менархе у обследованных женщин колебался от 11 до 15 лет и в среднем составил 13,6±0,3 года. У 28 (59,6%) женщин сразу установился регулярный менструальный цикл, у 8 (14,8%) – регулярный менструальный цикл установился в течение первого года после начала месячных и у 12 (17,2%) – через год и более. У 2 (10%) больных наблюдалась первичная аменорея. Нерегулярный менструальный цикл с момента менархе до проведения обследования наблюдался у 19 (42,97%) женщин. У матерей 2 (10%) больных имелась вторичная аменорея.
У большинства обследованных больных (42,8%) наблюдались аденовирусные и респираторные заболевания в анамнезе. Хронический тонзиллит имели 7,2% женщин. Кроме того, в анамнезе у обследованных женщин имелись следующие заболевания: хронический пиелонефрит – у 3,6%, хронический холецистит – у 2,4%, хронический гастрит – у 3,0%, язвенная болезнь. Среди обследованных женщин 25 (50%) не имели беременностей. Большинство больных 41 (85,0%) страдали первичным бесплодием, 9 страдали вторичным бесплодием.
Всем женщинам было проведено общеклиническое и гинекологическое обследование. Для уточнения раз меровматки, толщины эндометрия и состояния яичников всем больным было произведено ультразвуковое исследование. Исследование проводилось на аппарате абдоминальным секторным датчиком с рабочей частотой 3,5 МГц. Некоторым больным дополнительно выполнялось исследование на аппарате фирмы Брюль и Кьер (Дания) с вагинальным секторным датчиком с рабочей частотой 7–10 МГц. Признаки гипоплазии матки выявлены у 17 (36%) больных. У 18 (36,4%) женщин яичники были обычной структуры. Поликистозные яичники были выявлены у 15 (42,8%) больных. Всем больным была произведена обзорная рентгенография черепа и прицельные снимки области турецкого седла с целью исключения объемного процесса в гипофизе. Ни в одном случае отклонений от нормы не было выявлено.
У обследованных женщин выявлены разные типы яичниковой недостаточности: ановуляция – у 23 (46%) больных и недостаточность лютеиновой фазы цикла – у 10 (20%) больных.
Клинические проявления нарушения менструального цикла у обследованных женщин были разнообразны: олигоменорея у 11 (21%) больных, олигоопсоменорея – у 13 (24,8%) больных, гиперполименорея – у 5 (10%).
К провоцирующим факторам, которые могли играть роль в инициации нарушений менструального цикла, по данным анамнеза, относились:
- эмоционально-психическая травма – у 7 (14,0%) женщин;
- перемена климата – у 13 (21%) женщины;
- снижение массы тела – у 22 (45,3%) женщин.
Следует отметить, что на фоне приема Прегнотона у многих больных нормализовался менструальный цикл, уменьшились проявления нарушений в виде дисменореи, пришел в норму уровень прогестерона (табл. 6).
Анализируя ситуацию, связанную с уровнем микронутриентов, следует понимать, что подавляющее число женщин (76%) в периоде преконцепции испытывают дефицит в организме микронутриентов, что связано с их урбанизированным уровнем жизни и нарушением пищеварения (табл. 7) [7].
Прегнотон принимался женщинами для подготовки организма к беременности. Они отмечали приятный дынный вкус препарата. За время приема Прегнотона была зарегистрирована 1 нежелательная реакция на компоненты препарата (по-видимому, витамин С) в виде шелушения кожных покровов на лице через 10 нед применения.
На фоне применения Прегнотона были отмечены снижение уровня эмоциональной лабильности в предменструальном периоде, повышение работоспособности и оживление элементов гетеросексуального влечения на фоне возросшей длительности лютеиновой фазы цикла. Этот препарат восполнил недостаток витаминов и минералов, которые необходимы на этапе подготовки к зачатию. Компоненты Прегнотона нормализовали менструальный цикл, улучшали кровообращение и насыщение тканей кислородом в органах малого таза по данным ультразвукового исследования органов малого таза и таким образом повышали женскую фертильность, создавая оптимальные условия для наступления беременности [7, 8].
Основным результатом нашего исследования в 1-й группе больных с мужским фактором секреторного бесплодия и относительной гиперпролактинемией у партнерш этих больных были нормализация пограничных значений гипепролактинемии и зарегистрированное наступление 2 беременностей на протяжении 4 мес наблюдения. У 3 партнерш мужчин 2-й группы было документировано наличие беременностей.
Обсуждение
Оценив результаты лечения обследуемых больных, мы пришли к выводу, что стратегия профессионального сопровождения пары при бесплодии с участием гинеколога и уролога является более эффективной, чем разрозненное и несогласованное ведение этих больных.
Результаты совместной подготовки пары препаратами Спематон и Прегнотон при секреторном бесплодии мужчин и в послеоперационном ведении больных, перенесших варикоцелэктомию, позволяют предположить не только половой, но и лекарственный синергизм, направленный на улучшение репродуктивной функции пары в целом. Спематон зарекомендовал себя как препарат выбора при идиопатическом бесплодии, в послеоперационном ведении больных с целью более быстрого восстановления фертильности мужчины. Следует отметить, что 3 мес являются достаточным сроком для улучшения функциональных параметров сперматозоидов. По результатам сравнительного анализа данных спермограмм выявлено, что объем эякулята после лечения в среднем увеличился на 11,4%, в большей степени за счет 1-й группы больных. Концентрация сперматозоидов в 1 мл возросла на 32,5% в 1-й группе и на 25% – во 2-й группе. Быстрая подвижность сперматозоидов (А) выросла в 1-й группе на 100%, а во 2-й – на 62%, медленное поступательное движение сперматозоидов (В) уменьшилось в 1-й группе на 34%, во 2-й – на 18% (p < 0,05). Данные изменения коррелировали с эластографическими изменениями структуры придатка и яичка. Контрольные исследования показали, что в группах больных с варикоцеле происходит снижение коэффициентов эластичности ткани в среднем на 1,6 раза по сравнению с исходными данными, что коррелирует с восстановлением сперматогенеза у этих больных. Проведенные исследования электронной микроскопии сперматозоидов позволили сделать предположения о возможном влиянии антиоксидантов препарата Спематон на уменьшение фрагментации хроматина. Рациональное содержание L-карнитина позволяет предположить его влияние на сохранение мембраны акросомы и повышение метаболизма митохондрий сперматозоидов.
Прием 2 саше-пакетов у мужчин не приводит к статистически значимой разнице по эффективности воздействия на сперматогенез по сравнению с приемом Спематона в количестве 1 саше-пакета в сутки.
Таким образом, Спематон позволяет повысить мужскую фертильность, улучшая функциональное состояние мужской репродуктивной системы: улучшает качественные и количественные показатели спермограммы (улучшает морфологию сперматозоидов, увеличивает их подвижность, концентрацию, и объем эякулята) и восполняет недостаток витамина Е и цинка. Спематон не вызывал аллергических реакций и других побочных явлений.
Оценка эффективности препарата Прегнотон у женщин выявила очевидные преимущества. К ним можно отнести снижение относительно повышенного уровня пролактина, удлинение лютеиновой фазы менструального цикла, нормализацию месячных, уменьшение болевого компонента и повышение уровня прогестерона.
Новая стратегия профессионального медицинского сопровождения пары при бесплодии препаратами Спематон и Прегнотон, является эффективной за счет правильной подборки компонентов [9–12]. У партнерш мужчин в семьях с мужским фактором бесплодия одной из причин ненаступления беременности является стрессово-детерминированное повышение уровня пролактина. Экстракт витекса способствует нормализации уровня пролактина, улучшению баланса эстрогенов и прогестерона, что приводит к нормализации менструального цикла и более частому наступлению беременности. Прегнотон, таким образом, улучшает функциональное состояние женской репродуктивной системы: восполняет недостаток витаминов и минералов, необходимых для правильного формирования и развития плода на ранних стадиях беременности; способствует восстановлению организма после стрессов и повышенных эмоциональных нагрузок; снижает относительно повышенный уровень пролактина и позволяет нормализовать менструальный цикл (в случае нарушений, вызванных стрессами). Прегнотон не оказывает влияния на артериальное давление и может применяться при гипотонии. Если изначальный уровень пролактина был в норме, прием Прегнотона не будет оказывать какого-либо отрицательного эффекта на менструальный цикл и организм в целом.
Применение комплекса препаратов Спематон и Прегнотон эффективно и безопасно для будущих родителей.
Литература
- Сухих Г.Т., Божедомов В.А. Мужское бесплодие. М.: Эксмо, 2008.
- Вишневский А.С., Сафронникова Н.Р., Мельникова Н.Ю., Григорьева Т.А. Новые подходы к синдрому гиперпролактинемии. Журнал акушерства и женских болезней. 2000; 1 (XLIX): 39–41.
- Berger D. Vitex Agnes castus: Unbedenklichkeit and Wirksamkeit beim praemenstruellen Syndrom, Wirkprinzipien und Wirkmechanismen eines neuetwickelten Extraktes. Dissertation, Phil.-Naturwissen-scgrtliche Fakultat, Universitat Basel, 1998.
- Jarr H, Leonhardt S, Wuttke W, Behr B et al. Agnus castus als dopaminerges Wirkprinzip in Mastodynon. N Zeitschrift fur Phytotherapie 1991; 12: 77–82.
- Виноградов И.В., Капто А.А., Афанасьева Л.М. Опыт применения Карнитина у больных с идиопатической патоспермией. Проблемы репродукции. 2009; 1:. 76–7.
- Zini A, AL-Hatal N. Антиоксидантная терапия при мужском бесплодии: факт или вымысел. Азиатский журн. андрологии. 2011; 13: 1–9.
- Манухин И.Б, Федорова Т.Н., Смирнова С.О, Кузнецова Е.М. Гипеандрогения и оксидативный стресс. Проблемы репродукции. 2012; 2: 41–5.
- Vicari E, Calogero AE. Effects of treatment with carnitines in infertile patients with prostato-vesiculo-epididymis. Hum Reprod 2001; 16 (11): 2338–42.
- Курило Л.Ф. Руководство ВОЗ по исследованию и обработке эякулята человека. 5-е изд. ВОЗ. Медикогенетический научный центр Российской академии медицинских наук. М.: Капитал принт, 2012.
- Жуков О.Б., Верзин А.В., Пеньков П.Л. Современные методы хирургического лечения варикоцеле. Андрология и генитальная хирургия. 2012; 3: 4–15.
- Жуков О.Б., Уколов В.А., Жуков А.А. Комплексная терапия патоспермии у больных после рентгеноэндовпаскулярной склеротерапии тестикулярных вен. Андрология и генитальная хирургия. 2012; 4: 70–9.
- Божедомов В.А., Торопцева М.В., Ушакова И.В. и др. Активные формы кислорода и репродуктивная функция мужчин: фундаментальные и клинические аспекты. Андрология и генитальная хирургия. 2011; 3.
Источник изображений на данной странице – Shutterstock / Fotodom.
