К. Г. Серебренникова, Е. П. Кузнецова, Е. С. Ванке, Т. В. Иванова, Ю. В. Милославский

Цель исследования. Оценка эффективности прегравидарной подготовки с применением специализированного комплекса и гормональной терапии у пациенток с диагностированным бесплодием и клиникой тонкого эндометрия.
Материал и методы. В исследование были включены 145 пациенток с установленным диагнозом бесплодие в возрасте 25–42 лет и проведением стимуляции суперовуляции с использованием агонистов и антагонистов ГнРГ в анамнезе. В первую группу вошли 65 пациенток, перенесших оперативные вмешательства на яичниках, которым не проводилась прегравидарная подготовка; во вторую группу были включены 60 пациенток, перенесших оперативные вмешательства на яичниках, которые получали прегравидарную подготовку к программам ВРТ в течение 2–3 мес., в виде комплекса прегнотон с использованием гормональной терапии. Группу сравнения составили 20 пациенток с интактными яичниками и трубно-перитонеальным фактором бесплодия. Исследование осуществлялось в рамках подготовки пациенток к проведению протокола вспомогательных репродуктивных технологий.
Результаты. В первой группе после проведения протокола ВРТ беременность наступила в 15,5% случаев, во второй и третьей группе – в 31,7 и 35% случаях соответственно.
Заключение. Комплексная прегравидарная подготовка, включающая комплекс прегнотон, в сочетании с гормональной терапией, позволяет не только увеличить процент наступления беременности, но и снизить риск осложнений беременности, и тем самым повлиять на перинатальные и младенческие потери.
Ключевые слова: бесплодие, прегравидарная подготовка, беременность, прегнотон, трансдермальный 17β-эстрадиол (дивигель).
PREGRAVID PREPARATION IN PATIENTS WITH THE THIN ENDOMETRIUM IN ASSISTED REPRODUCTIVE TECHNOLOGY PROGRAMS
K.G. Serebrennikova, E.P. Kuznetsova, E.S. Vanke, T.V. Ivanova, Yu.V. Miloslavsky
Objective. To evaluate the efficiency of pregravid preparation using a specialized complex and hormonal therapy in patients with diagnosed infertility and clinical presentations of the thin endometrium.
Subjects and methods. The investigation enrolled 145 patients aged 25–42 years with an established diagnosis of infertility and a history of superovulation using GnRH agonists and antagonists. Group 1 included 65 patients who had undergone a surgery on the ovaries and received no pregravid preparation; Group 2 consisted of 60 patients who had a surgery on the ovaries and pregravid preparation for assisted reproductive technology (ART) programs during 2-3 months as the complex Pregnoton in combination with hormone therapy. The comparison group comprised 20 patients with intact ovaries and tuboperitoneal factor infertility. The investigation was conducted within the preparation of patients for an assisted reproductive technology protocol.
Results. After implementing the ART protocol, pregnancy occurred in 15.5, 31.7, and 35% of cases in Groups 1, 2, and 3, respectively.
Conclusion. Comprehensive pregravid preparation, including the complex Pregnoton in combination with hormonal therapy, makes it possible not only to increase the rate of pregnancy, but also to lower a risk for pregnancy complications, and thus affecting perinatal and infant losses.
Key words: infertility, pregravid preparation, pregnancy, Pregnoton, transdermal 17β-estradiol (Divigel).
Введение
Репродуктивные потери при использовании вспомогательных репродуктивных технологий (ВРТ) занимают одно из ведущих мест в лечении бесплодия. На сегодняшний день как врачу амбулаторного звена, так и врачам-репродуктологам известно, что вне зависимости от анамнеза женщины она должна быть физиологически и психологически готова к беременности [1–3]. Отдельного внимания врачейрепродуктологов заслуживают пациентки с проблемой тонкого эндометрия, возникшей в результате многих причин.
К причинам нарушения имплантации и формирования тонкого эндометрия относятся:
- различные варианты внутриматочной патологии (внутриматочная перегородка, внутриматочные синехии, субмукозная миома матки, рецидивирующий полипоз, гиперпластические процессы) – как сами по себе, так и методы их лечения;
- тяжелые формы эндометриоза, аденомиоз;
- медикаментозное лечение (репродуктивнотоксическая терапия, химиотерапевтические препараты, цитостатики, некоторые гормональные препараты);
- аутоиммунные процессы [4–6].
Как известно, патогенез формирования «неполноценного», «тонкого» эндометрия заключается в нарушении взаимоотношения между экзо- или эндогенными эстрогенами и рецепторным аппаратом эндометрия. Как гипо-, так и гиперэстрогения одинаково плохо отражаются на толщине и качестве эндометрия. При гипоэстрогении не происходит формирования достаточного количества рецепторов к эстрогенам, в связи с чем эндометрий становится малочувствительным к эстрогенам и прогестерону [7–10]. Пациенток с гипоэстрогенией в практике репродуктолога около 40%. Это могут быть пациентки позднего репродуктивного возраста, пациентки после перенесенных операциях на яичниках, пациентки с идиопатическим ПНЯ (преждевременная недостаточность яичников). При гиперэстрогении высокие уровни эстрогенов подавляют рецепторы в эндометрии, что часто можно наблюдать в гиперстимулированном цикле.
Все это приводит к недостаточности формирования так называемого «имплантационного окна» – периода максимальной восприимчивости эндометрия, характеризующегося экспрессией рецепторов специфических генов и факторов роста, позволяющих прежде рефрактерному эндометрию предоставить возможность для нидации эмбриона.
Отдельной группой стоят пациентки, у которых проблемы тонкого эндометрия обусловлены предшествующими внутриматочными манипуляциями. Эффективность результатов экстракорпорального оплодотворения (ЭКО) и переноса эмбрионов (ПЭ) у пациенток зависит от многих факторов, так как тонкий эндометрий – лишь один из патогномоничных признаков гипоэстрогении. Например, у пациенток с оперативными вмешательствами на яичниках состояние эндометрия характеризуется различными изменениями как в гистологической структуре, так и в его рецептивности за счет нарушения экспрессии рецепторов стероидных гормонов, маркеров пролиферативной активности, нарушения формирования пиноподий. Таким образом, прегравидарная подготовка у пациенток с тонким эндометрием является ключевым фактором в подготовке к процедурам и методам лечения, направленным на достижение беременности. Для этого необходимо стремиться к нормализации состояния рецепторов эндометрия, синхронизации его фазовых изменений, восстановлению местного иммунитета и нормального кровоснабжения матки и эндометрия. Обоснованными методами прегравидарной подготовки являются препараты, влияющие на физиологическое улучшение состояния репродуктивной системы и, в дальнейшем, на состояние плода, которые непосредственно препятствуют развитию как ранних, так и поздних осложнений во время оплодотворения, нидации и гестации беременности [11–14]. Необходимо помнить о важности приема препаратов фолиевой кислоты в прегравидарной подготовке, так как дефицит фолиевой кислоты во время беременности связан с множеством осложнений, включая не только врожденные дефекты, пороки развития и дефекты нервной трубки, но также самопроизвольные выкидыши и преждевременные роды [13].
Аминокислота аргинин играет важную роль в поддержке репродуктивного здоровья. Продемонстрированные в экспериментальных и клинических исследованиях позитивные эффекты аргинина на поддержку беременности связаны не столько с ролью аргинина как «строительного материала», сколько с другими биологическими факторами этой аминокислоты. В организме аргинин метаболизируется в оксид азота (II), орнитин и пролин, необходимые для поддержки ряда физиологических процессов во время беременности. Ингибирование синтетазы оксида азота нарушает оплодотворение яйцеклетки [15]. Орнитин и пролин существенны для синтеза полиаминов, регулирующих экспрессию генов и синтез белка в матке и плаценте. Аргинин регулирует функцию гипофиза и увеличивает маточный кровоток. Пероральный прием аргинина ускоряет рост плода при задержке внутриутробного развития (ЗВУР) плода [16, 17]. Поэтому дотации аргинина также способствуют поддержке нормального уровня артериального давления и снижают риск развития преэклампсии. В качестве препарата, содержащего компоненты, наиболее важные для прегравидарной подготовки женщин с тонким эндометрием, заслуживает внимание прегнотон. В его состав входят L-аргинин, фолиевая кислота, экстракт витекса священного, витамины Е, С, В2 , В6 и минералы цинк, магний, селен, йод. Рекомендуется также назначение препаратов омега-3-полиненасыщенных жирных кислот (ПНЖК), которые на сегодняшний день представляют собой один из перспективных, но мало используемых резервов для прегравидарной подготовки. Омега-3-ПНЖК оказывают влияние и на плазменное звено гемостаза (активируют процессы фибринолиза, снижают уровень фибриногена), обладают иммуномодулирующим действием [18]. Доказано важное влияние витамина D на эндометрий. Он является регулятором эндометриальной экспрессии HOXA10, гена, критичного для процесса имплантации, который участвует во взаимодействии эмбриона и эндометрия с помощью различных молекулярных и цитокиновых механизмов [10, 12, 19–21].
Определено, что оптимальная толщина эндометрия на момент переноса эмбриона в полость матки должна составлять 8–12 мм. Абсолютное большинство исследований показывают, что эндометрий толщиной менее 8 мм является прогностически неблагоприятным фактором в отношении наступления и исхода беременности в циклах ВРТ, в частности ранней потери беременности и высокой частоты внематочной беременности [18, 22, 23].
Материалы и методы исследования
В исследование были включены 145 пациенток с установленным диагнозом бесплодие в возрасте 25–42 лет, из них 125 имели оперативные вмешательства на яичниках, клинику тонкого эндометрия в анамнезе и наблюдались в отделении гинекологии с применением ВРТ Центральной клинической больницы РАН (Москва). У остальных 20 пациенток был диагностирован трубно-перитонеальный фактор бесплодия. У всех пациенток была проведена стимуляция суперовуляции с использованием агонистов и антагонистов ГнРГ в анамнезе. 125 пациенток с оперативными вмешательствами на яичниках в анамнезе были разделены на 2 группы.
Первая группа – ретроспективная, состоящая из 65 пациенток, которым не проводилась прегравидарная подготовка. Вторая группа – проспективная, состоящая из 60 пациенток. Данные пациентки получали прегравидарную подготовку к программам ВРТ в течение 2-3 мес., в виде специализированного комплекса прегнотон. Для коррекции дефицита витамина D пациентки получали препарат ультра-д в дозах от 1000 до 4000 МЕ в зависимости от лабораторных показателей, а также гормональную терапию, содержащую трансдермальный точно дозированный 17β-эстрадиол (дивигель) в режиме дозирования 1-2 мг/сутки с 1-го по 28-й день в комбинации с прогестероном с 14-го по 25-й день менструального цикла, в течение 2–3 месяцев.
Группу сравнения составили 20 пациенток с интактными яичниками и трубно-перитонеальным фактором бесплодия. Пациентки всех трех групп были сопоставимы по антропометрическим показателям. В ходе исследования всем женщинам было проведено тщательное клинико-лабораторное обследование, оценка овариального резерва, ультразвуковое исследование органов малого таза в I и II фазу менструального цикла.
Пациенткам в проспективной группе было выполнено иммуногистохимическое исследование эндометрия. Забор материала проводили в ожидаемом «окне имплантации» – на 7–10-й постовуляторный день 28-дневного менструального цикла. С помощью гистероскопии проводилась биопсия эндометрия либо, по показаниям, раздельное выскабливание слизистой оболочки цервикального канала и полости матки. Интенсивность иммуногистохимических реакций к α/β-рецепторам эстрогена и прогестерона в ядрах клеток эпителия желез и стромы определяли по методу гистологического счета H-score. Степень выраженности экспрессии рецепторов оценивали следующим образом: 0–10 баллов — отсутствие экспрессии, 11–100 — слабая экспрессия, 101–200 — умеренная экспрессия, 201–300 — выраженная экспрессия. Интенсивность иммуногистохимических реакций к белку Ki-67 рассчитывали в процентах (количество окрашенных ядер на 100 клеток).
Пациенткам с нарушением стероидной рецепции (RP и RE2 ) и пролиферативной активности (исследование белка Ki-67) проводили прегравидарную подготовку, включающую заместительную гормональную терапию в течение 2–3 месяцев до включения в программу ВРТ с целью повышения эффективности лечения. Показанием для назначения гормонотерапии было нарушение эхо-структуры эндометрия как в I, так и во II фазе менструального цикла (р=0,001) по данным ультразвукового исследования и стероидной рецепции (железы, строма) белка Ki-67. Стимуляция суперовуляции проводилась с использованием агонистов и антагонистов гонадотропин-рилизинг гормона. Были использованы препараты рекомбинантного фолликулостимулирующего гормона (ФСГ), препараты, содержащие рекомбинантный ФСГ и рекомбинантный лютеинизирующий гормон (ЛГ) и человеческие менопаузальные гонадотропины, содержащие в равных долях ФСГ и ЛГ.
Контроль эффективности стимуляции суперовуляции осуществляли с помощью оценки качества полученных ооцитов и эмбрионов и при динамическом обследовании, и при наблюдении. Оценку зрелости полученных ооцитов производили по состоянию комплексов ооцит-кумулюс. Оплодотворение проводилось методами ЭКО и интрацитоплазматической инъекции сперматозоида в яйцеклетку. На конечном этапе исследования осуществлялся анализ частоты наступления беременности
Статистическая обработка результатов исследования проводилась с помощью программного пакета статистической обработки данных — IBM SPSS Statistics 10. Полученные цифровые результаты исследования обрабатывали методами вариационной статистики. Результаты исследования представлены в виде частот и процента допустимых либо как М (среднее) ± m (стандартная ошибка среднего значения). Различия между сравниваемыми величинами признавали достоверно значимыми при р<0,05
Результаты исследования
Анализируя анамнестические данные, выявили, что длительность бесплодия в ретроспективной группе составила в среднем 5,6±0,4 года, в проспективной — 5,3±0,7 года, в контрольной — 4,1±0,77 года. Было обнаружено, что у большинства пациенток выявлены сочетанные факторы бесплодия. В ретроспективной и проспективных группах чаще выявлялось первичное бесплодие, в 40 (61,54%) и 31 (51,67%) случаях соответственно. Эндокринное бесплодие наблюдалось у большинства пациенток из ретроспективной – 49 (75,38%) и проспективной – 53 (88,33%) групп.
Менструальная функция не была нарушена ни у одной из пациенток. Средний возраст наступления менархе у пациенток всех трех группа был сопоставим (различия не достоверны, р=0,09), в ретроспективной группе он составил 12,9±0,5 года, в проспективной — 12,6±0,5 года, в контрольной — 12,6±0,7 года. У всех респонденток менструальный цикл установился сразу. При тщательном анализе было выявлено, что у большинства из них в проспективной и ретроспективной группах менструации были не обильными.
Достоверно чаще (р>0,0001) вне зависимости от возраста были выполнены органосохраняющие оперативные вмешательства на яичниках — цистэктомия и резекция. Причем в проспективной группе чаще проводилась цистэктомия (табл. 1).
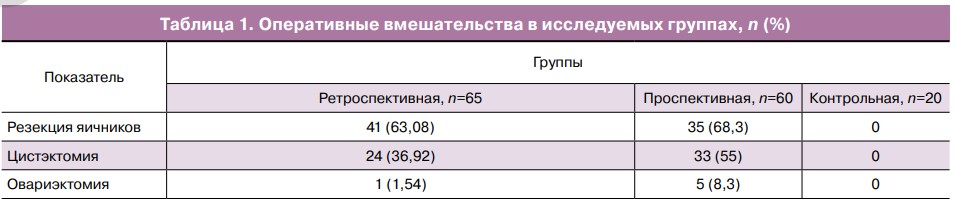
Результаты морфологического исследования удаленных тканей играли важную роль в планировании дальнейшего комплекса мероприятий, направленных на преодоление бесплодного брака. Наиболее частой причиной оперативных вмешательств на яичниках были эндометриоидные кисты: 28 (43,08%) в ретроспективной и 33 (55,0%) в проспективной группах. Фолликулярные кисты были причиной хирургического вмешательства в 21,54 и 20,0% соответственно. Кисты желтого тела встречались у 21,54% пациенток в ретроспективной группе и 15% в проспективной группе. В остальных единичных случаях наблюдались дермоидная киста, простая киста, серозная цистаденома, муцинозная цистаденома, фиброма яичника.
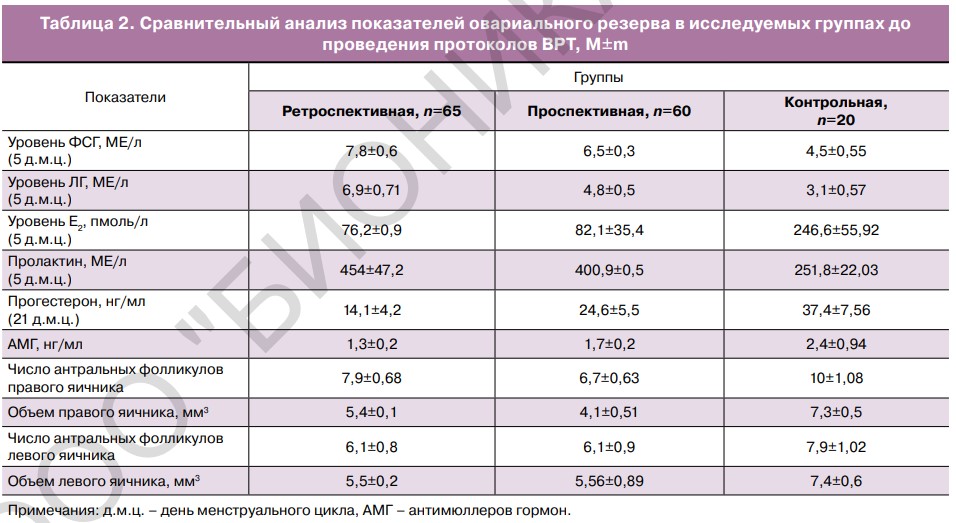
При оценке овариального резерва было выявлено его снижение в группах пациенток с оперированными яичниками. При лабораторном обследовании выявлены изменения в гормональном статусе у пациенток, перенесших оперативные вмешательства на яичниках. Также было отмечено повышение ФСГ и ЛГ, обусловленное снижением эстрадиола, а также пролактина. При оценке уровня прогестерона во II фазу менструального цикла выявлено, что у пациенток с оперированными яичниками чаще наблюдалась недостаточность лютеиновой фазы (табл. 2).
В результате проведенного иммуногистохимического исследования при бесплодии у пациенток с гипоэстрогенией было обнаружено, что уровень эстрогеновых рецепторов α (ЭРα) в железах в целом превышал нормальные показатели в 2,5 раза, а уровень этих рецепторов в строме был выше в 1,25 раза. Количество прогестероновых рецепторов (ПР) как в железах, так и в строме было ниже нормальных показателей. У пациенток с трубно-перитонеальным фактором бесплодия экспрессия ПР в железах была несколько повышена и равнялась 142,6±11,8 балла. Экспрессия ПР в строме достоверно уступала нормальным показателям (150,8±8,7 балла). А экспрессия ЭРα и в железах, и строме достоверно превышала норму – 155,6±11,3 и 125,6±9,8 балла соответственно. Достоверной разницы в экспрессии ПР в строме и ЭРα в железах при первичном и вторичном бесплодии не обнаружено, но при вторичном бесплодии эти показатели были несколько ниже, чем при первичном.
Учитывая полученные данные, пациенткам в проспективной группе с нарушением рецептивности эндометрия перед программами ВРТ осуществлялась нормализация микробиоценоза влагалища, также была проведена прегравидарная подготовка, включающая комплекс прегнотон, витамин D3 (ультра-д по 1000–4000 МЕ/сут) и гормональную терапию, содержащую трансдермальный точно дозированный 17β-эстрадиол (дивигель) в режиме дозирования 1–2 мг/сутки с 1-го по 28-й день менструального цикла в комбинации с прогестероном с 14-го по 25-й день, в течение 2–3 месяцев.
Анализ проведенных циклов ВРТ показал, что в ретроспективной группе суммарная доза гонадотропинов на цикл стимуляции составила от 1750 до 3450 МЕ, в среднем 2260,45±125 МЕ. В связи с тем, что в группе были пациентки с оперированными как правым, так и левым яичниками, а также с вмешательствами на обоих яичниках, количество фолликулов, полученных при трансвагинальной пункции, было приблизительно одинаковым (правый яичник – 3±0,64, левый яичник – 3,2±0,88 соответственно). Стимуляция овуляции проводилась в течение 11,3±1,25 дня. При трансвагинальной пункции фолликулов и аспирации их содержимого было получено 4,6±0,85 ооцитов (количество ооцитов стадии 2pn составило 2,5±0,74), из них зрелых 2±0,48 (М2). Количество эмбрионов при переносе – 1±0,15. В данной группе беременность наступила в 15,5% протоколов. У 55,5% женщин беременность завершилась родами. При анализе данных в проспективной группе было выявлено, что суммарная доза гонадотропинов на цикл стимуляции составила от 750 до 1525 МЕ, в среднем 1138,54±112,5 МЕ. В данной группе получено почти равное количество фолликулов при стимуляции суперовуляции: правый яичник – 4,6±0,59, левый яичник – 4,3±0,63. Стимуляция овуляции проводилась в течение 13,1±1,2 дня. При трансвагинальной пункции фолликулов и аспирации их содержимого было получено в среднем 6,3±0,86 ооцитов (количество ооцитов стадии 2pn составило 4,2±0,51). Из них зрелые М2 5,77±0,45. Количество эмбрионов при переносе 3,4±0,14. Беременность наступила в 31,7% протоколов. Показатель живорожденности составил 63,16%.
В группе контроля было проведено 20 протоколов стимуляции суперовуляции у 20 женщин. Суммарная доза гонадотропинов на цикл стимуляции составила от 1000 до 3375 МЕ, в среднем 1277,5±135,83 МЕ. В правом яичнике получено больше фолликулов (8,3±0,99). Стимуляция проводилась в течение 12,7±0,24 дня. В среднем было получено 9,7±1,35 ооцита, из них зрелые МII (7±0,92). Количество эмбрионов при переносе – 2,5±0,5. Беременность наступила в 35,0% протоколов. Родами завершилось 57,14% беременностей.
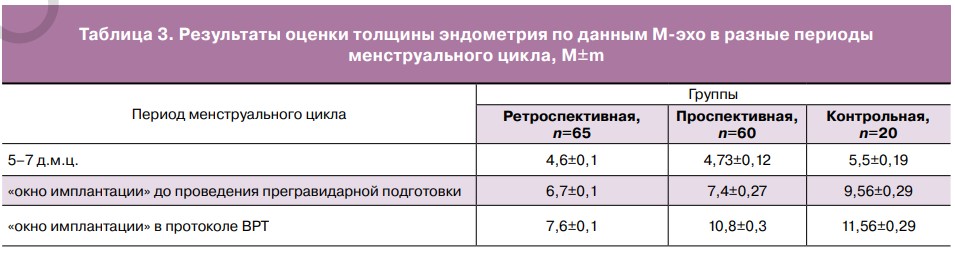
Также в проспективной группе толщина эндометрия после проведения курса прегравидарной подготовки с включением гормональной терапии составила 10,48±0,3 мм, что соответствует оптимальным значениям толщины эндометрия в «окно имплантации» согласно литературным источникам (табл. 3). Данные результаты показывают, что операции по поводу кист и доброкачественных образований яичников влияют на овариальный резерв, что подтверждается сниженным количеством полученных фолликулов и ооцитов. Но проведенная прегравидарная подготовка, включающая гормональную терапию эстрогенами и прогестагенами (точно дозированный 17β-эстрадиол + прогестаген) для подготовки эндометрия позволила увеличить процент наступления беременности в два раза в проспективной группе по сравнению с ретроспективной, процент наступления беременностей был близок к контрольной группе. Также обращает на себя внимание тот факт, что при проведении прегравидарной подготовки в протоколе ВРТ (проспективная группа) были использованы более низкие дозы гонадотропинов, получено большее число зрелых ооцитов и бластоцист по сравнению с ретроспективной группой, в которой не проводилась прегравидарная подготовка.
Заключение
Таким образом, включение препарата прегнотон в комплексную прегравидарную подготовку пациенток с тонким эндометрием в программах вспомогательных репродуктивных технологий позволяет улучшить результаты ЭКО и переноса эмбрионов. Подобный подход способствует увеличению процента наступления беременности и снижению риска осложнений, оказывая положительное влияние на перинатальные и младенческие потери.
Литература/References
- Кузнецова И.В. Гормональная контрацепция и прегравидарная подготовка: можно ли совместить? Проблемы репродукции. 2013; 1: 21-5. [Kuznetsova I.V. Hormonal contraception and pregravid preparation: can it be combined? Problemyi reproduktsii. 2013; 1: 21-5. (in Russian)]
- Прегравидарная подготовка: клинический протокол. Авт.-сост. Радзинский В.Е. и др. М.: Редакция журнала StatusPraesens; 2016. [Preprogrammed training: clinical protocol. Auto-comp. Radzinsky V.E. And others. Moscow: Editorial Board of the journal StatusPraesens; 2016. (in Russian)]
- Серебренникова К.Г., Ванке Е.С., Кузнецова Е.П., Иванова Т.В., Милославский Ю.В. Влияние прегравидарной подготовки у пациенток с оперированными яичниками в программах вспомогательных репродуктивных технологий. Гинекология. 2015; 17(4): 52-6. [Serebrennikova K.G., Vanke E.S., Kuznetsova E.P., Ivanova T.V., Miloslavskiy Yu.V. The effect of pregravid preparation in patients with operated ovaries in programs of assisted reproductive technologies. Ginekologiya. 2015; 17(4): 52-6. (in Russian)]
- Калинченко С.Ю., Жиленко М.И., Гусакова Д.А., Дымова А.В. Подготовка к беременности женщин с гипоплазией эндометрия. Гинекология. 2014; 16(5): 62-6. [Kalinchenko S.Yu., Zhilenko M.I., Gusakova D.A., Dyimova A.V. Preparation for pregnancy of women with endometrial hypoplasia. Ginekologiya. 2014; 16(5): 62-6. (in Russian)]
- Аншина М.Б., Исакова Э.В., Калинина Е.Анат., Калинина Е.Андр., Корсак В.С., Краснопольская К.В., Назаренко Т.А., Серебренникова К.Г., Смирнова А.А., Смольникова В.Ю. Применение эстрогенов в программах ВРТ. Научно-практические рекомендации. М.: Российская Ассоциация Репродукции Человека; 2015. 80с. [Anshina M.B., Isakova E.V., Kalinina E.Anat., Kalinina E.Andr., Korsak V.S., Krasnopolskaya K.V., Nazarenko T.A., Serebrennikova K.G., Smirnova A.A., Smolnikova V.Yu. The use of estrogens in ART programs. Scientific and practical recommendations. Moscow: Russian Association of Human Reproduction; 2015. 80p. (in Russian)]
- Назаренко Т.А., Корсак В.С. Эстрогены в репродуктивной медицине. М.: МЕДпресс-информ; 2016. [Nazarenko T.A., Korsak V.S. Estrogens in reproductive medicine. Moscow: MEDpress-inform; 2016. (in Russian)]
- Громова О.А., Торшин И.Ю., Джиджихия Л.К., Гоголева И.В. Роли витамина D в профилактике и лечении женского бесплодия. Гинекология. 2016; 18(3): 34-9. [Gromova O.A., Torshin I.Yu., Dzhidzhihiya L.K., Gogoleva I.V. The role of vitamin D in the prevention and treatment of female infertility. Ginekologiya. 2016; 18(3): 34-9. (in Russian)]
- Elassar A., Mann J.S., Engmann L., Nulsen J., Benadiva C. Luteal phase estradiol versus luteal phase estradiol and antagonist protocol for controlled ovarian stimulation before in vitro fertilization in poor responders. Fertil. Steril. 2011; 95(1): 324-6.
- Holick M.F. Vitamin D deficiency. N. Engl. J. Med. 2007; 357(3): 266-81.
- Lerchbaum E., Rabe T. Vitamin D and female fertility. Curr. Opin. Obstet. Gynecol. 2014; 26(3): 145-50.
- Kutlusoy F., Guler I., Erdem M., Erdem A,. Bozkurt N., Biberoglu E.H., Biberoglu K.O. Luteal phase support with estrogen in addition to progesterone increases pregnancy rates in in vitro fertilization cycles with poor response to gonadotropins. Gynecol. Endocrinol. 2014; 30(5): 363-6.
- Ozkan S., Jindal S., Greenseid K., Shu J., Zeitlian G., Hickmon C., Pal L. Replete vitamin D stores predict reproductive success following IVF. Fertil. Steril. 2010; 94(4): 1314-9.
- Rudick B., Ingles S., Chung K., Stanczyk F., Paulson R., Bendikson K. Characterizing the influence of vitamin D levels on IVF outcomes. Hum. Reprod. 2012; 27(11): 3321-7.
- Chang X., Wu J. Effects of luteal estradiol pre-treatment on the outcome of IVF in poor ovarian responders. Gynecol. Endocrinol. 2013; 29(3): 196- 200.
- Romero-Aguirregomezcorta J., Santa A.P., Garcia-Vazquez F.A., Coy P., Matas C. Nitric Oxide Synthase (NOS) inhibition during porcine in vitro maturation modifies oocyte protein S-nitrosylation and in vitro fertilization. PLoS One. 2014; 9(12): e115004.
- Wu G., Bazer F.W., Satterfield M.C., Li X., Wang X., Johnson G.A. et al. Impacts of arginine nutrition on embryonic and fetal development in mammals. Amino Acids. 2013; 45(2): 241-56.
- Zeng X., Mao X., Huang Z., Wang F., Wu G., Qiao S. Arginine enhances embryo implantation in rats through PI3K/PKB/mTOR/NO signaling pathway during early pregnancy. Reproduction. 2013; 145(1): 1-7.
- Кира Е.Ф., Артымук Н.В., Савичева А.М., Роговская С.И., Гущин А.Е., Румянцева Т.А., Иванова О.В. Применение молочной кислоты в сочетании с гликогеном для лечения бактериального вагиноза. Гинекология. 2015; 17(2): 93-6. [Kira E.F., Artyimuk N.V., Savicheva A.M., Rogovskaya S.I., Guschin A.E., Rumyantseva T.A., Ivanova O.V. The use of lactic acid in combination with glycogen for the treatment of bacterial vaginosis. Ginekologiya. 2015; 17(2): 93-6. (in Russian)]
- Rudick B.J., Ingles S.A., Chung K., Stanczyk F.Z., Paulson R.J., Bendikson K.A. Influence of vitamin D levels on in vitro fertilization outcomes in donor-recipient cycles. Fertil. Steril. 2014; 101(2): 447-52.
- Farzadi L., Khayatzadeh Bidgoli H., Ghojazadeh M., Bahrami Z., Fattahi A., Latifi Z. et al. Correlation between follicular fluid 25-OH vitamin D and assisted reproductive outcomes. Iran. J. Reprod. Med. 2015; 13(6): 361-6.
- Polyzos N.P., Anckaert E., Guzman L., Schiettecatte J., Van Landuyt L., Camus M. et al. Vitamin D deficiency and pregnancy rates in women undergoing single embryo, blastocyst stage, transfer (SET) for IVF/ICSI. Hum. Reprod. 2014; 29(9): 2032-40.
- Шестакова И.Г., Дикке Г.Б. Эстрогендефицитные состояния у молодых женщин: что мы можем? Эстрогены в амбулаторном лечении женщин репродуктивного возраста. Информационный бюллетень. Радзинский В.Е., ред. М.: Редакция журнала StatusPraesens; 2016: №16. [Shestakova I.G., Dicke G.B. Estrogen deficiency conditions in young women: what can we do? Estrogens in outpatient treatment of women of reproductive age. News bulletin. Radzinsky V.E., ed. Moscow: Editorial office of the journal StatusPraesens; 2016: №16. (in Russian)]
- Baerwald A.R., Pierson R.A. Endometrial development in association with ovarian follicular waves during the menstrual cycle. Ultrasound Obstet. Gynecol. 2004; 24(4): 453-60.
Источник изображений на данной странице – Shutterstock / Fotodom.
