Манухина Е.И., Испас А.А.

ФГБОУ ВО «Московский медико-стоматологический университет им. А.И. Евдокимова», Москва, Россия.
Цель. Представить собственный опыт применения витаминно-минерального комплекса «Прегнотон» в восстановлении менструального цикла у пациенток с функциональной гиперпролактинемией.
Материалы и методы. Проведено обследование 135 пациенток репродуктивного возраста с функциональной гиперпролактинемией и нарушениями менструального цикла до и после 3-месячного курса применения прегнотона.
Результаты. Через месяц приема прегнотона 80/135 (59,2%) наблюдаемых отметили значительное улучшения общего самочувствия (улучшение настроения, наладился сон), у 26/135 (19,2%) менструальный цикл восстановился и стал регулярным. После прохождения полного курса прегнотона (3 месяца) значительное улучшение состояния было отмечено у 115/135 (85,2 %) пациенток, восстановление менструального цикла было отмечено у 110/135 (81,5%) больных.
Заключение. Применение сбалансированного витаминно-минерального комплекса (прегнотон) оказывает положительный эффект на общее самочувствие женщины (улучшает настроение, налаживает сон), и может использоваться при лечении нарушении менструального цикла у пациенток с функциональной гиперпролактинемией. Существенный эффект от приема прегнотона следует ожидать после прохождения 3-месячного курса лечения.
Ключевые слова: функциональная гиперпролактинемия, нарушения менструального цикла, прегнотон.
Вклад авторов. Манухина Е.И., Испас А.А.: изучение литературы, курация пациенток, сбор анамнестических, клинических, лабораторных данных, анализ и статистическая обработка полученных результатов, написание текста статьи, редактирование.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки.
Для цитирования: Манухина Е.И., Испас А.А.: Опыт применения витаминно-минерального комплекса в восстановлении менструального цикла у пациенток с функциональной гиперпролактинемией.
Акушерство и гинекология. 2020; 2:
Akusherstvo i Ginekologiya/ Obstetrics and gynecology. 2020;2: (In Russian).
Манухина Екатерина Игоревна, д.м.н. профессор, ФГБОУ ВО «Московский медико-стоматологический университет им. А.И. Евдокимова». Е-mail: katemanu@mail.ru
Адрес: 127473, Россия, Москва, Делегатская ул., д. 20.
Испас Анастасия Анатольевна, врач акушер-гинеколог, ГБУЗ ГКБ им. Е.О. Мухина. Е-mail: ispasanastasia@mail.ru
Адрес: 127473, Россия, Москва, Делегатская ул., д. 20.
About the authors:
Ekaterina I. Manukhina, MD, professor, FSFEI HE Moscow A. I. Evdokimov University of Medicine and Dentistry. Е-mail: katemanu@mail.ru
Address: 127473, Russia, Moscow, Delegatskaya str., bld. 20.
Anastasia A. Ispas, obstetrician-gynecologist of state budgetary healthcare institution, city clinical hospital named after E.O. Mukhin. Е-mail: ispasanastasia@mail.ru
Address: 127473, Russia, Moscow, Delegatskaya str., bld. 20.
Гиперпролактинемия — это состояние, которое характеризуется стойким избыточным содержанием в сыворотке крови пролактина (ПРЛ) [1], сопровождается различными патологическими изменениями, такими как нарушение половой функции, бесплодие, ожирение, метаболический синдром, остеопороз и т.д. Гиперпролактинемия является важной междисциплинарной медицинской проблемой, что указывает на необходимость знакомства с ней не только акушеров-гинекологов, эндокринологов, но и врачей других специальностей (андролог, уролог и т.д.). Накопленные клинические и экспериментальные данные показали, что нарушение секреции пролактина и связанного с ним симптомокомплекса возникают как при первичном поражении пролактинсекретирующих структур, так и при других эндокринных и неэндокринных заболеваниях, а также при приеме некоторых фармакологических препаратов. Эти данные легли в основу современного представления о первичной гиперпролактинемии как самостоятельной нозологической единицы и ее вторичных формах, наблюдаемых при других заболеваниях [4, 9].
Синдром гиперпролактинемии — симптомокомплекс, который развивается на фоне гиперпролактинемии и сопровождается нарушениями менструальной и репродуктивной функций у женщин. В нашей стране синдромом гиперпролактинемии могут страдать от 214 000 до 2 млн человек, 80% из них женщины детородного возраста [2]. Частота гиперпролактинемии при нарушениях менструального цикла по типу олигоменореи, аменореи составляет 40%, а при бесплодии – 18–25% [3].
Функциональная гиперпролактинемия характеризуется увеличением секреции ПРЛ при неясной причине этого состояния. Данный диагноз в качестве самостоятельного заболевания устанавливают только после исключения всех известных причин гиперпродукции ПРЛ. Этиология заболевания остается неясной. Предполагают, что в ее основе лежат нарушения нейромедиаторного контроля продукции гормона на уровне гипоталамуса [3–5]. Частота идиопатической гиперпролактинемии у женщин с бесплодием составляет 12–45% [3–6]. Вариабельность показателей зависит от точности диагностики, которая, в свою очередь, определяется спектром клинико-лабораторных и рентгенологических методов обследования. Возможно, в дальнейшем проведение фундаментальных исследований, посвященных изучению механизмов синтеза, секреции ПРЛ и его биологических эффектов, а также совершенствование методов диагностики поставят под сомнение существование такой формы заболевания, как идиопатическая гиперпролактинемия [3].
Основные клинические проявления гиперпролактинемии неопухолевого генеза — нарушение менструального цикла по типу олигоменореи (~62%) на фоне ановуляции или недостаточности лютеиновой фазы (НЛФ), регулярный ритм менструаций (~38%) при наличии полноценной или неполноценной лютеиновой фазы цикла, галакторея (~30–78%). Активность ПРЛ в плазме крови не превышает 3000 мМЕ/л, и почти у каждой второй, особенно при регулярном ритме менструаций, нарушение его секреции имеет транзиторный характер. Преобладает первичное бесплодие [1–3, 7]. Гиперпролактинемия проявляется нарушениями менструального цикла по типу гипо-, олиго-, опсо- и аменореи, а также бесплодием. У женщин с гиперпролактинемией нередко наблюдается галакторея, причем она не всегда коррелирует с уровнем пролактина. Так, галакторея возможна и при нормальном его уровне, что связано с гиперчувствительностью рецепторов пролактина в молочной железе.
Терапия пациенток с гиперпролактинемией не ограничивается применением селективных и неселективных дофаминомиметиков. Существуют и другие возможности коррекции патологической гиперпролактинемии, в том числе с помощью растительных средств [10]. Доказано, что растение Agnus castus обладает дофаминергическим действием, приводит к мягкому снижению продукции пролактина [11], что крайне важно при коррекции функциональной гиперпролактинемии с невысокими цифрами пролактина.
Цель исследования – представить собственный опыт применения прегнотона в восстановлении менструального цикла у пациенток с функциональной гиперпролактинемией.
Материалы и методы
В период с 2018 по 2019 г. на клинической базе кафедры акушерства и гинекологии лечебного факультета МГМСУ им. А.И. Евдокимова, женская консультация при ГКБ № 57 им. Д. Д. Плетнёва, проведено обследование 135 пациенток репродуктивного возраста с функциональной гиперпролактинемией и нарушениями менструального цикла. Прегнотон принимали по одному саше 1 раз в день перед едой. Продолжительность курса составила 3 месяца. Обследование пациенток выполняли трижды: до лечения, после 1-го месяца лечения и после лечения через 3 месяца.
Критериями включения стали: репродуктивный возраст; отсутствие инфекций репродуктивного тракта; отсутствие выраженной соматической патологии, исключены эндокринные синдромы (синдром поликистозных яичников (СПКЯ), неклассическая форма врожденной дисфункции коры надпочечников (НК-ВДКН)); отмена за 3 и более месяцев, предшествовавших исследованию, гормональных препаратов и других медикаментов, влияющих на уровень половых стероидов; отсутствие сопутствующей эндокринной патологии (нарушения функции щитовидной железы); исключение рака молочной железы (РМЖ), эндометрия или других гормонозависимых опухолей.
Критерии исключения: нарушения овуляции, непроходимость маточных труб, распространенный эндометриоз.
Все пациентки, участвовавшие в исследовании, дали свое письменное согласие. Исследование было одобрено на заседании этической комиссии при ГКБ № 57 им. Д. Д. Плетнёва.
У всех пациенток, включенных в исследование, на начальном этапе был проведен сбор анамнестических данных и заполнены специально разработанные анкеты. При оценке показателей созревания репродуктивной системы учитывали: возраст менархе, характер становления менструального цикла, последовательность появления вторичных половых признаков (телархе и пубархе). Уточняли возраст возникновения, причины, длительность, характер нарушений менструального цикла. Активность пролактина определяли на 4–5-й день менструального цикла методом иммуноферментного анализа на анализаторе Sunrise (TECAN Austria GmbH) с использованием наборов Biofource, Бельгия. Уровень пролактина колебался от 890 до 1000 мМЕ/мл. В качестве нормативных значений использовали пределы нормы, разработанные в лаборатории эндокринологии Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии им. академика В.И. Кулакова (концентрация пролактин в сыворотке крови у женщин репродуктивного возраста, от 120 до 500 мМЕ/л). Используемая биологически активная добавка Прегнотон не вызвали аллергических реакций и других побочных явлений.
Результаты и обсуждение
Выбор препарата Прегнотон для лечения нарушений менструального цикла был не случайным. Препарат отличает полифункциональность, мягкость действия, наличие эффекта последействия, отсутствие развития лекарственной болезни и эффекта «отмены». Хорошо изучен механизм действия входящего в состав данного препарата экстракта растения Agnus castus, который действует как конкурентный ингибитор D2-рецепторов допамина (препятствует супрафизиологическому высвобождению пролактина из лактотрофов гипофиза). Кроме того, устраняет действие допамина, серотонина, норадреналина и других нейротрансмиттеров и способствует улучшению созревания фолликула и повышению активности желтого тела [3, 5, 6].
Средний возраст исследуемых женщин составил 31±5 лет. Ни у одной пациентки не было выраженных метаболических расстройств. При изучении преморбидного фона у больных с гиперпролактинемией превышения числа перенесенных в детском возрасте инфекционных заболеваний по сравнению с данными в популяции не отмечено. Средний возраст наступления менархе составил 12,9±0,5 года. У всех респонденток менструальный цикл установился сразу. Вместе с тем у 30/135 (22,2%) обследованных пациенток имели место заболевания центральной нервной системы и перенесенные травмы головного мозга. Практически у каждой второй пациентки в структуре сопутствующей экстрагенитальной заболеваемости преобладала патология желудочно-кишечного тракта, в том числе гепатобилиарной системы 15/135 (11,1%). В этом аспекте немаловажен тот факт, что 40/135 (29,6%) пациенток в течение двух предшествовавших настоящему обследованию лет перенесли эндоскопическую холецистэктомию по поводу желчнокаменной болезни, еще у 3 клинические проявления совпали с тяжелыми стрессовыми ситуациями в семье. Наши данные, как и многочисленные указания в литературе, в том числе эпидемиологические исследования, подтверждают значимость стрессорного фактора в развитии неопухолевой гиперпролактинемии [3, 6, 7]. К провоцирующим фактором возникновения гиперпролактинемии также можно отнести длительное применение эстроген-гестагенных оральных контрацептивов (1,5–2 года) [3]. Влияние данной категории препаратов на секрецию пролактина общеизвестно. Как эндогенные, так и экзогенные эстрогены, входящие в состав комбинированных оральных контрацептивов и препаратов для заместительной гормонотерапии, использующихся в пери- и постменопаузальном периоде, активируют эстроген-чувствительный элемент гена пролактина и способствуют увеличению синтеза и секреции последнего. Оральные контрацептивы, возможно, не вызывают образования пролактином, но способны стимулировать их развитие и обычно не назначаются пациенткам с такими опухолями [4, 12].
При тщательном анализе особенностей менструальной функции, из нарушений менструального цикла, до лечения, у пациенток было выявлено: гипоменорея – у 20/135 (14,8%), олигоменорея – у 25/135 (18,6%), опсоменорея у 10/135 (7,4 %), полименорея – у 30/135 (22,2 %) и у 50/135 (37 %) пациенток была отмечена альгоменорея.
Динамика уровня пролактина у исследуемых пациенток представлена в таблице.

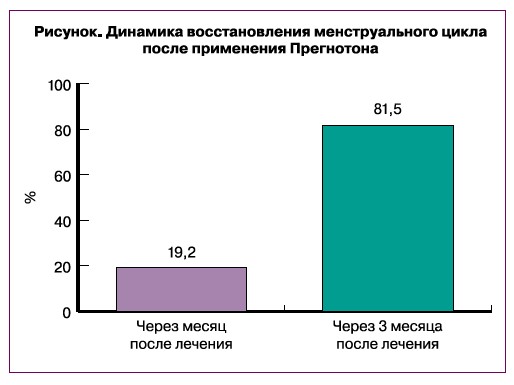
Прегнотон обладает пролактинингибирующим действием. Допаминэргическая активность данного препарата доказана в клинико-экспериментальных исследованиях. При этом он не снижает базальный уровень пролактина. В случаях латентной гиперпролактинемии наблюдается некоторое снижение или, по меньшей мере, тенденция к снижению активности пролактина и улучшение клинической картины. В связи с этим препараты из экстрактов плодов Vitex agnus castus в гинекологической практике применяются при нарушениях менструального цикла, недостаточности желтого тела, предменструальном синдроме, циклической масталгии и фиброзно-кистозной мастопатии [5, 6, 8]. Через месяц приема Прегнотона 80/135 (59,2%) наблюдаемых отметили значительное улучшения своего общего состояния, у 26/135 (19,2%) менструальный цикл восстановился. После прохождения полного курса Прегнотона (3 месяца) значительное улучшение состояния было отмечено у 115/135 (85,2%) пациенток, восстановление менструального цикла – у 110/135 (81,5%) (рисунок). Таким образом, существенный эффект от приема Прегнотона следует ожидать после прохождения 3-месячного курса лечения.
Заключение
Применение сбалансированного витаминно-минерального комплекса (Прегнотон) оказывает положительный эффект на общее самочувствие женщины (улучшает настроение, налаживает сон) и может использоваться при лечении нарушении менструального цикла у пациенток с функциональной гиперпролактинемией.
Литература / References
- Громова О.А., Торшин И.Ю. Витамины и микронутриенты: между Сциллой и Харибдой. МЦНМО, 2013; 869. [Gromova O.A., Torshin I.Ju. Vitaminy i mikronutrienty: mezhdu Scilloj i Haribdoj. MCNMO, 2013; 869. (in Russian)].
- Дедов И.И., Мельниченко Г.А, Романцова Т.И. Эндокринология. Национальное руководство. М.: ГЭОТАР–Медиа, 2015: 589–94. [Dedov I.I., Melnichenko G.A., Romantsova T.I. Endocrinilogy: National guide. M.: GEOTAR-Media. 2015; 589–94. (In Russ.)].
- Дедов И.И., ред. Клиническая нейроэндокринология. М. 2011: 113–8. [Dedov I.I., red. Klinicheskaya neyroendokrinologiya. M. 2011: 113–8. (in Russian)].
- Иловайская И.А. Диагностика и лечение гиперпролактинемии: клинические рекомендации Международного эндокринологического общества и взгляд российских экспертов. Фарматека: Акушерство и гинекология. 2012, 1: 2–7. [Ilovayskaya I.A. Diagnostika i lecheniye giperprolaktinemii: klinicheskiye rekomendatsii Mezhdunarodnogo endokrinologicheskogo obshchestva i vzglyad rossiyskikh ekspertov. Farmateka: Akusherstvo i ginekologiya. 2012; 1: 2–7. (in Russian)].
- Melmed S., Casanueva F.F., Hoffman A.R. Diagnosis and treatment of hyperprolactinemia: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011; 96(2): 273–88. doi: 10.1210/jc.2010-1692.
- Подзолкова Н.М., Глазкова О.Л. Симптом, синдром, диагноз. Дифференциальная диагностика в гинекологии.[Электронный ресурс]. М.: ГЭОТАР-Медиа, 2014. 736 с. N.M., Glazkova O.L. Symptom, syndrome, diagnosis. Differential diagnosis in gynecology. [Electronic resource]. M.: GEOTAR-Media, 2014.736 p.
- Ларина А.А., Григорян О.Р., Андреева Е.Н., Дзеранова Л.К. Гиперпролактинемия и беременность. Проблемы репродукции. 2013; 3: 13–17. [Larina A.A., Grigorian O.R., Andreeva E.N., Dzeranova L.K.The hyperprolactinemia and pregnancy (a review). Russian Journal of Human Reproduction = Problemy reproduktsii. 2013; (3): 13–17. (In Russan)]
- Babey M., Sahli R., Vajtai I., Andres R.H., Seiler R.W. Pituitary surgery for small prolactinomas as an alternative to treatment with dopamine agonist. Pituitary. 2011; 14: 222–30. doi: 10.1007/s11102-010-0283-y.
- Famini P., Maya M.M., Melmed S. Pituitary magnetic resonance imaging for sellar and parasellar masses: ten-year experience in 2598 patients. J Clin Endocrinol Metabol. 2011; 96: 1633–41. doi: 10.1210/jc.2011-0168.
- Герасимович Е.М. Гормональные и метаболические нарушения при использовании препаратов заместительной гормональной терапии и препаратов растительного происхождения. Мед. новости. 2008; 1: 98–102. [Gerasimovich, E.M. Gormonalnye i metabolicheskie narusheniya pri ispolzovanii preparatov zamestitelnoy gormonalnoy terapii i preparatov rastitelnogo proishozhdeniya. Med. novosti. 2008; 1: 98–102. (in Russian)]
- Вуттке В., Ярри Г., Зайдлова-Вуттке Д. Терапевтические возможности экстрактов из Аврамова дерева (Vitex Agnus castus) в гинекологической практике. Проблемы репродукции. 2009; 4: 53–7.[Vuttke, V., Yarri G., Zaydlova-Vuttke D. Terapevticheskie vozmozhnosti ekstraktov iz Avramova dereva (VitexAgnuscastus) v ginekologicheskoy praktike. Problemi reprodukcii. 2009; 4: 53–7. (in Russian)].
- Wu G., Bazer F.W., Satterfield M.C., Li X., Wang X., Johnson G.A., Burghardt R.C., Dai Z., Wang J., Wu Z. Impacts of arginine nutrition on embryonic and fetal development in mammals. Amino Acids. 2013; 45(2): 241–56.
Источник изображений на данной странице – Shutterstock / Fotodom.
