А. Агарвал
Реферат
L-карнитин (LC) и L-ацетил-карнитин (ALC) обнаруживаются в высоких концентрациях в придатке яичка и играют важную роль в метаболизме и созревании сперматозоидов. Они также влияют на подвижность сперматозоидов и являются антиоксидантами. Целью данного обзора является обобщение знаний о многочисленных функциях, которые LC и ALC выполняют в мужской репродуктивной системе, а также освещение использования карнитинов в лечении мужского бесплодия. Ряд исследований подтверждают, что LC и ALC в дозировках 3 г/день достоверно увеличивают концентрацию и общее количество сперматозоидов у мужчин с астено- и олигоастенозооспермией. Хотя позитивные эффекты LC и ALC были продемонстрированы во множестве клинических исследований, большинство таких исследований не были плацебо-контролируемыми и двойными слепыми, что не позволяет использовать их выводы как окончательные. Для подтверждения целесообразности использования карнитинов в лечении мужского бесплодия, особенно у мужчин с плохим качеством сперматозоидов, требуются дополнительные исследования.
Введение
Карнитин является высокополярным соединением, широко распространенным в природе. Потребности человека в карнитине удовлетворяются за счет эндогенного биосинтеза и диеты [Bieber, 1988]. В мужской половой системе карнитин концентрируется в придатке яичка и сперматозоидах. В извергнутой семенной жидкости большая часть карнитина находится в семенной плазме – очень малое количество содержится внутри сперматозоидов [Bohmer et al., 1978].
LC и ALC играют ключевую роль в метаболизме сперматозоидов, обеспечивая доступность энергии, используемой сперматозоидами для подвижности, созревания и процесса сперматогенеза. Функция карнитина в метаболизме заключается в транспорте длинноцепочечных жирных кислот через внутреннюю мембрану митохондрий для их использования в процессе β-окисления [Matalliotakis et al., 2000]. Карнитин также защищает клетки от активных форм кислорода (РФК), благодаря своим антиоксидантным свойствам. Эти свойства обеспечиваются его участием в удалении токсичного внутриклеточного ацетил-кофермента А и/или замене жирных кислот в мембранах [Vicari и Calogero, 2001]. Основываясь на знаниях об этих фундаментальных механизмах, проводились многочисленные клинические исследования, в которых была предпринята попытка продемонстрировать терапевтические эффекты LC и/или ALC для лечения мужчин с разными формами мужского бесплодия. Более того, в ряде in vitro исследований было отмечено увеличение подвижности сперматозоидов под действием карнитина, а также его криопротекторные свойства.
В статье делается обзор карнитина, включая данные о его структуре, происхождении, роли в сперматогенезе и положительном влиянии, оказываемом им на метаболизм сперматозоидов. Также обсуждается возможность использования карнитина для диагностирования мужского бесплодия. Наконец, данный обзор ставит целью прояснить границы и возможности использования карнитина для лечения мужского бесплодия.
Структура карнитина, источники
L-карнитин является высокополярным, водорастворимым, небольшим четырехчленным амином. В отличие от многих других биологических видов человек может синтезировать LC de novo. Однако LC, присутствующий в человеческих тканях, в основном имеет экзогенное происхождение [Engle и Rebouche, 1984].
Экзогенный карнитин поступает в организм с пищей: его источниками являются мясо, рыба, птица и молочные продукты. В течение долгого времени предполагалось, что, поскольку карнитин может быть синтезирован эндогенно, то он не является обязательным составляющим рациона. Однако исследования с участием строгих вегетарианцев показали, что уровень карнитина в их крови гораздо ниже, чем у людей с разнообразной диетой. Это может быть объяснено тем, что строгие вегетарианцы получают только 0,1 мкмоль/кг/день карнитина с пищей, тогда как люди с всеядной диетой получают 2–12 мкмоль/кг/день [Rebouche, 1988].
Распределение карнитина в половой системе
L-карнитин секретируется из эпителия млекопитающих в плазму придатка яичка и в конечном счете попадает внутрь сперматозоидов, где он накапливается в виде свободного или ацетилированного L-карнитина. Мужской половой тракт содержит отделы с наибольшей концентрацией карнитина в человеческом организме: ткани придатка яичка, семенная плазма и сперматозоиды. У млекопитающих свободный карнитин семенной плазмы в основном имеет эпидидимальное происхождение.
В многочисленных исследованиях на моделях животных было изучено присутствие карнитина в половом тракте. В исследовании, в котором измерялась концентрация карнитина в люминальной жидкости из яичка и придатка, было показано, что:
- концентрация карнитина в семенной жидкости яичка составляет < 1 ммоль/л;
- концентрация увеличивается в течение полового тракта до 53 ммоль/л в хвосте придатка яичка. Высокая концентрация впервые наблюдается в люминальной жидкости из дистального отдела хвоста придатка яичка, т.е. в том отделе, где сперматозоиды становятся подвижными [Hinton et al., 1979]. Схожий механизм концентрирования карнитина выявлен и у людей: содержание карнитина в придатке в 10–50 раз больше, чем в плазме крови, увеличиваясь в течение полового тракта так же как у крыс [Bohmer et al., 1978].
Такая высокая концентрация, судя по всему (по крайней мере, у крыс), зависит от андрогенов, т.к. при введении тестостерона молодым кастрированным самцам крыс наблюдалось увеличение концентрации карнитина, а у животных с крипторхизмом уровень карнитина был понижен [Brooks et al., 1974]. Несмотря на это, не обнаруживается корреляция между уровнем тестостерона в яичках и концентрацией карнитина в придатках яичка. Такое расхождение, скорее всего, объясняется тем, что карнитин накапливается в органах в течение долгого времени, в то время как концентрация тестостерона быстро изменяется вместе с гонадотропином [Bohmer et al., 1978].
Транспорт карнитина
Свободный карнитин транспортируется из плазмы в полость придатка яичка. Предполагается, что механизм транспорта состоит из активной базолатеральной и апикальной транспортных систем [Yeung et al., 1980]. Недавно было обнаружено, что высокоаффинный Na+-зависимый транспортер органических катионов OCTN2 переносит LC в клетки эпидидимального эпителия [Rodriguez et al., 2002]. Был также идентифицирован и охарактеризован другой карнитиновый транспортер, названный карнитиновым транспортером 2 (CT2). По сравнению с OCTN2, у которого отмечается широкая субстратная специфичность, CT2 является селективным переносчиком карнитина в яичках. Локализация CT2 была установлена иммуногистохимическими методами – было обнаружено, что у людей CT2 выявляется в придатке яичка, что служит подтверждением гипотезы о том, что CT2 отвечает за секрецию LC из эпителия придатка яичка в проток [Enomoto et al., 2002].
Функции карнитина
Карнитин в основном находится в матриксе митохондрий, где расположены ферменты, отвечающие за β-окисление длинноцепочечных жирных кислот. LC играет ключевую роль в β-окислении длинноцепочечных жирных кислот в митохондриях [Jeulin и Lewin, 1996]. LC регулирует поступление ацильных групп, транспортируя свободные жирные кислоты и производные ацил-кофермента А внутри митохондрий, и тем самым регулирует энергетический метаболизм. Во время транспорта через клеточную мембрану ацильные группы временно присоединяются к LC, с образованием ALC. Схожим образом карнитин обеспечивает транспорт ацетильных групп через ALC (схема 1). Конечным результатом этих реакций является модуляция концентрации митохондриального кофермента А, который участвует в ряди метаболических каскадов, таких как цикл трикарбоновых кислот (цикл Кребса) и β-окисление органических кислот и окислительная деградация аминокислот [Bahl и Brestler, 1987].
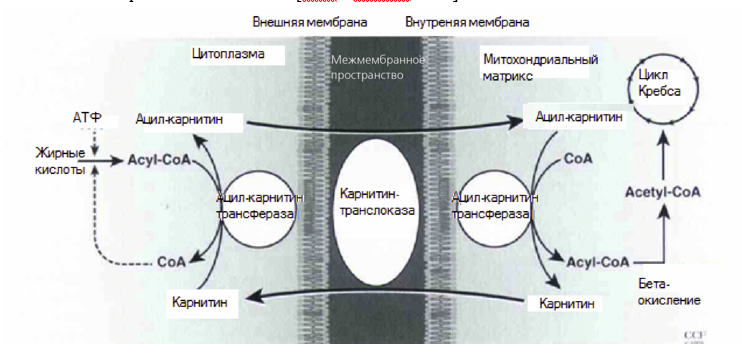
Схема 1. Транспорт ацильных групп и роль карнитина в митохондриальном метаболизме сперматозоидов
Постгонадное созревание сперматозоидов происходит главным образом в головке придатка яичка, где сперматозоиды находятся в плазме, содержащей факторы как тестикулярного так и эпидидимального происхождения. Сперматозоиды впервые сталкиваются с высокими концентрациями карнитина в протоке придатка яичка, т.е. в том же месте, где они приобретают способность к направленному движению. Таким образом, может быть установлена связь между инициацией направленного движения сперматозоидов (на конечных стадиях сперматогенеза) и значительным увеличением концентрации свободного LC и ALC в сперматозоидах [Jeulin et al, 1987].
В яичках крыс обнаруживается достаточно высокая концентрация карнитина (вдвое меньшая, чем в придатке яичка), что свидетельствует о том, что карнитин также необходим на тестикулярном уровне. В подтверждение этой гипотезы в сперматоцитах и развивающейся ткани яичка обнаруживается высокая концентрация ALC-трансферазы [Schanbacher et al., 1974].
Карнитин может косвенным образом влиять на созревание сперматозоидов через стимуляцию захвата глюкозы клетками Сертоли. Клетки Сертоли являются важнейшим отделом, контролирующим сперматогенез. Добавление LC к культуре клеток Сертоли приводит к увеличению секреции пирувата и лактата, которые являются важнейшими энергетическими субстратами для созревающих половых клеток [Palmero et al., 2000].
Предполагается, что высокая концентрация карнитинов в эпидидимальной жидкости необходима для поддержания их в состоянии покоя [Rufo et al., 1984; Deaan et al., 1989]. Было замечено, что высокая концентрация карнитина ингибирует выведение ферментов из клетки и потребление кислорода, увеличивая клеточную выживаемость и стабилизируя плазматическую мембрану [Jenkins и Griffith, 1986]. Эта гипотеза подтверждается тем фактом, что карнитин уменьшает вероятность акросомальной реакции в человеческих сперматозоидах [Deana et al., 1988].
Оксидативный стресс в мужских половых клетках ведет к повреждению сперматозоидов и нарушению целостности ядра и митохондрий [Aitken et al., 2003]. В целом антиоксидантная биохимическая система может быть описана как двухуровневая система: основной защитный барьер, предотвращающий оксидативное повреждение через улавливание окисляющих радикалов, и вторичный защитный механизм, который восстанавливает повреждения, причиненные оксидативной атакой [Arduini, 1992]. В результате окислительного стресса сперматозоиды теряют способность к слиянию из-за потери ненасыщенных жирных кислот вследствие окисления [Aitken et al., 2003]. Карнитин, возможно, защищает сперматозоиды от окислительного повреждения, удаляя избыточный клеточный ацетил-КоА (первичная антиоксидантная защита) [Arduini, 1992; Vicari и Calogero, 2001].
С другой стороны, ALC ингибирует включение арахидоновой кислоты в фосфолипиды. Арахидоновая кислота сама по себе играет большую роль в образовании свободных радикалов кислорода. В дополнение к этому она является важным депо для аккумулирования лизофосфолипидов после повреждения фосфолипидов клеточной мембраны в результате оксидативного повреждения. Эта роль является критической для механизма восстановления мембраны после ее повреждения РФК (вторичная антиоксидантная защита) [Pignatelli et al., 2003]. Хотя у карнитина были обнаружены антиоксидантные свойства [Schinetti et al., 1989; Ochendorf, 1999], их совокупный эффект на качество семени остается спорным [Alvarez, 2003].
Карнитин в качестве средства диагностики
Эпидидимальный / тестикулярный маркер
Были проведены многочисленные исследования для обнаружения биохимических маркеров созревания и функционирования сперматозоидов [Cayli et al., 2003]. Включение показателей эпидидимальной функции для анализа спермы имеет большое значение, т.к. придаток яичка непосредственно участвует в подготовке сперматозоидов к оплодотворению [Wetterauer, 1986]. С этой точки зрения роль карнитина крайне важна, т.к. сперматозоиды содержат высочайшие концентрации карнитинацетилтрансферазы и карнитин накапливается в сперматозоидах во время их созревания в придатке яичка, в то время как концентрация карнитина наиболее высока в придатке яичка [Marquis и Fritz, 1965; Frenkel et al., 1974].
Большая часть карнитина придатка яичка обнаруживается в его головке, что отражает секреторную функцию этой области [Bohmer et al., 1978]. Предположили, что содержание таких эпидидимальных маркеров, как LC, в эякуляте будет снижено у мужчин с воспалением придатка яичка [Cooper et al., 1990]. У пациентов с воспалением придатка яичка концентрация карнитина была снижена в 2 раза по сравнению с мужчинами с нормальной эпидидимальной функцией [Lewin et al., 1976]. Более того, утолщение придатка яичка, которое может возникать и как следствие воспаления и de novo, было тесно ассоциировано с существенным снижением уровня карнитина в семенной жидкости [Cooper et al., 1988].
Уровень активной карнитинацетилтрансферазы, содержащейся в сперматозоидах, также является потенциально важным биомаркером тестикулярной функции. Активность этого фермента в 7 раз выше в первичных сперматозоидах, находящихся в диплотеновой стадии мейоза, чем в сперматогониях, и таким образом, может служить маркером дифференциации половых клеток.
Карнитин и мужское бесплодие
Качество и функционирование сперматозоидов улучшается при приеме LC и ALC [Comhaire и Mahmoud, 2003]. У мужчин, страдающих бесплодием, концентрация LC и ALC в семенной плазме колеблется от 200 до 1300 нмоль/мл и от 60 до 280 нмоль/мл соответственно. Была отмечена положительная корреляция между уровнем свободного LC и количеством сперматозоидов (r = 0,617; P < 0,01), подвижностью сперматозоидов (r = 0,614; P < 0,01) и количеством подвижных сперматозоидов/мл (r = 0,646; P < 0,01) [Menchini-Fabris et al., 1984]. Сходные данные были получены в исследовании, проведенном на 101 пациенте, страдающем бесплодием [Matalliotakis et al., 2000], в результате которого были выявлены четкие корреляции между уровнем LC в семени и плотностью (r = 0,711; P < 0,0001), подвижностью (r = 0,579; P < 0,0001) и морфологией сперматозоидов (r = 0,586; P < 0,001). Однако стоит заметить, что в этих исследованиях не было контрольной плацебо-группы и они не были двойными слепыми. В дополнение к этому критерии включения пациентов не были достаточно точно определены, что привело к включению в исследование пациентов с бесплодием разной этиологии.
Можно предположить, что существует связь между уровнем ALC и мужской фертильностью, т.к. мужчины с олигозооспермией имеют более низкий уровень ALC, чем фертильные контроли [Kohengkul et al., 1977]. В исследовании, где бесплодные мужчины с нормозооспермией сравнивались с фертильной контрольной группой, было установлено, что у мужчин, страдающих бесплодием, понижено количество свободного (295 против 521 мкмоль/л; P < 0,001) и общего карнитина (513 против 743 мкмоль/л; P < 0,001). Таким образом, можно предположить, что ALC является потенциальным диагностическим маркером для необъяснимых случаев бесплодия у мужчин с нормальными параметрами семени [Aopfgen et al., 2000].
Азооспермия
Еще одним потенциальным применением семенного LC является диагностика этиологии азооспермии. Потенциальный диагноз может быть основан на том факте, что карнитин в семенной плазме попадает туда из придатка яичка и семенных пузырьков. У мужчин с обструктивной азооспермией, при которой уровень постэпидидимальной обструкции очень высок, например, из-за недоразвития (агенеза) семяпровода, уровень карнитина значительно понижен (Menchini-Fabris et al., 1984). С другой стороны, у мужчин с обструкцией более низких отделов (внутритестикулярной или эпидидимально-тестикулярной) уровни карнитина остаются в пределах нормы [Saeed et al., 1994].
Астенозооспермия
Предполагается, что существует связь между карнитинами и подвижностью сперматозоидов. Сперматозоиды остаются неподвижными при их удалении с помощью микропункции из тех отделов головки придатка яичка, в которых уровень карнитинов еще не высок [Hinton et al., 1979]. Более того, добавление LC и ALC к человеческим сперматозоидам in vitro увеличивает их подвижность [Tanphaichitr, 1977].
Хотя отдельные значения уровней LC и ALC могут быть выше в образцах с астенозооспермией [Bartellini et al., 1987], соотношение ALC/LC и процент ацетилирования в них всегда понижен [Kohengkul et al., 1977; Golan et al., 1984; Bartellini et al., 1987]. Существенная разница в ALC/LC и проценте ацетилирования может быть объяснена дефектами ферментативной системы (карнитинтрансферазы), которая контролирует реакцию превращения карнитина в ацетилкарнитин, что, в свою очередь, ведет к снижению подвижности сперматозоидов.
Терапевтические эффекты карнитинов
Терапевтическая роль карнитинов подтверждается многочисленными наблюдениями, зафиксированными в литературе [Cassilas, 1973; Lewin et al., 1976; Johansen и Bohmer, 1979; Golan et al., 1984; Bartellini et al., 1987; Bieber, 1988; Jeulin и Lewin, 1996; Moore, 1998]. У мужчин с олигоастенозооспермией понижена концентрация LC [Lewin et al., 1976; Menchini-FAbris et al., 1984] и ALC [Kohengkul et al., 1977] по сравнению с фертильными мужчинами. Существует достоверная положительная корреляция между уровнем LC и количеством сперматозоидов, а также их подвижностью [Menchini-Fabris et al., 1984]. Эти наблюдения вместе с твердо установленной ролью LC и ALC в производстве энергии сперматозоидами создают научное обоснование для применения терапии LC и/или ALC для лечения многих случаев мужского бесплодия.
Исследования на животных
Для того чтобы охарактеризовать протекторное действие ALC в in vivo системе, был изучен процесс восстановления и созревания сперматозоидов у мышей. Мышей подвергли облучению для того, чтобы удалить сперматогонии, и затем им давали ALC в концентрации 100 мг/кг через день в течение 4 недель. Популяция сперматозоидов у мышей, получавших ALC, восстанавливалась быстрее, чем у контрольной группы [Amendola et al., 1989]. Таким образом, ALC, возможно, влияет на ранние стадии сперматогенеза, благодаря положительным эффектам на репарацию ДНК и пролиферацию и регенерацию половых клеток [Amendola et al., 1989]. Также было обнаружено, что ALC сокращает восстановительный период после гипертермического повреждения [Amendola et al., 1991], что может иметь важное значение для терапии гипертермического повреждения в случаях варикоцеле – одной из самых распространенных причин мужского бесплодия [Comhaire et al., 1976].
Карнитин также может оказывать протекторное действие от повреждения, вызванного электрическими и магнитными полями (ЭМП). В одном исследовании мыши, многократно подвергающиеся ЭМП и затем получавшие LC, быстрее восстанавливали количество сперматозоидов и их подвижность по сравнению с контрольной группой [Ramadan et al., 2002].
Прием триметилуксусной кислоты с питьевой водой снижает уровень карнитина в семенной сыворотке у крыс из-за выведения карнитинов с мочой в виде триметилацетилкарнитина. В одном исследовании был обнаружен эффект снижения карнитина у фертильных крыс и хомяков. Добавление триметилацетата (20 ммоль/л) в течение 5-недельного периода привело к снижению уровня карнитина в эпидидимальной жидкости на 50–70 %, однако не затронуло ни количество, ни подвижность сперматозоидов. Таким образом, снижение количества карнитина не является успешным способом мужской контрацепции [Cooper и Yeung, 1999].
Исследования in vitro
Увеличение подвижности
Сперматозоиды сохраняют до 50 % своей подвижности в течение 8 дней ко-инкубирования с культурами клеток придатка яичка (Moore, 1998). Способность карнитина увеличивать подвижность in vitro остается предметом споров. Экзогенный карнитин и ацетилкарнитин способны увеличивать подвижность сперматозоидов в мужском эякулированном семени, однако сам по себе карнитин не стимулирует подвижность т.к. его положительный эффект осуществляется только после его превращения в ацетилкарнитин. Этот вывод происходит из наблюдения, что карнитин может инициировать увеличение подвижности только при добавлении ацетата в культуру. Точный механизм остается не до конца выясненным.
Было показано, что добавление ацетилкарнитина к отмытой от семенной плазмы культуре сперматозоидов не приводит к увеличению подвижности, в отличие от добавления к неизмененным образцам сперме. Это свидетельствует о том, что ацетилкарнитин должен быть метаболизован и нуждается в транспорте внутрь клетки с помощью какого-то фактора, присутствующего в сперме. В отличие от других веществ, стимулирующих подвижность, таких как калликереин, которые действуют только на образцы с низкой подвижностью, карнитин увеличивает число подвижных сперматозоидов вне зависимости от первичной подвижности [Tanphaichitr, 1977].
Оплодотворение in vitro
Шанс зачатия у бесплодных пар может быть увеличен с помощью таких методов, как ЭКО и внутрицитоплазменная инъекция сперматозоида (ICSI). Было предпринято много попыток выяснить влияние факторов, в том числе и карнитина, присутствующего в плазме, на фертилизационный потенциал образцов спермы для ЭКО. В недавнем исследовании, проведенном на 24 мужчинах, участвующих в программе ЭКО, не было обнаружено достоверной разницы в содержании карнитина у тех пациентов, для которых ЭКО было успешным или нет [Lay et al., 2001]. Эти данные были подтверждены в более крупном исследовании (n = 178), в котором также не было найдено корреляции содержания карнитинов в семенной плазме и фертилизационного потенциала [Mieusset et al., 1989].
Криоконсервирование
Криоиндуцированное повреждение проявляется в основном в виде потери подвижности. Точные причины такой потери неизвестны, однако, скорее всего, на нее влияют множество факторов. Было предположено, что уменьшение подвижности сперматозоидов может быть связано с изменениями концентрации карнитина в плазме. После размораживания содержание ацетилкарнитина в сперматозоидах было существенно снижено, однако содержание карнитина в сперматозоидах и соотношение LC/ALC в плазме оставалось неизменным [Grizard et al., 1992].
Во многих экспериментах было показано, что совместная инкубация сперматозоидов с клетками придатка яичка увеличивает выживаемость первых, а также их подвижность после криоконсервации [Akhondi et al., 1997; Moore, 1998]. Это послужило обоснованием для использования богатых карнитином клеток придатка яичка в качестве криопротектора. Добавление питательной среды от клеток придатка яичка к сперматозоидам во время криоконсервации увеличивало их подвижность после размораживания [Reyes-Moreno et al., 2000]. Однако в другом сообщении было указано, что добавление ALC не увеличивало подвижность и не снижало повреждение мембран после размораживания [Duru et al., 2000].
Исследования in vivo
Во многих клинических исследованиях было обнаружено влияние LC и ALC на подвижность сперматозоидов у мужчин с астено- и олигоастенозооспермией [Costa et al., 1994; Vitali et al., 1995; Vicari и Catogero, 2001; Vicari et al., 2002; Lenzi et al., 2003]. Однако, с другой стороны, ряд других исследований не подтверждают достоверное влияние приема карнитина на параметры сперматозоидов [Moncada et al., 1992; Loumbakis et al., 1996]. Причинами таких расхождений могут быть слишком малая продолжительность терапии и недостаточные дозировки.
Антиоксидантные свойства карнитина могут быть использованы для эффективной терапии при увеличении концентрации РФК у пациентов с рецидивирующим или хроническим абактериальным воспалением полового тракта/придаточной железы. Терапевтический эффект был описан в работах группы Vicari и соавт. [Vicari и Calogero, 2001; Vicari et al., 2002]. У бесплодных пациентов с абактериальным простатовезиколоэпидидимитом, получавшим LC и ALC в течение 3–4 месяцев, было отмечено снижение концентрации РФК и увеличение подвижности сперматозоидов [Vicari и Calogero, 2001; Vicari et al., 2002]. Терапевтический эффект карнитина при лечении лейкоцитоспермии увеличивался после 2-месячного курса терапии нестероидными антивоспалительными средствами. Несмотря на то что результаты обоих исследований были статистически достоверными, их недостатком являлось отсутствие контрольной группы.
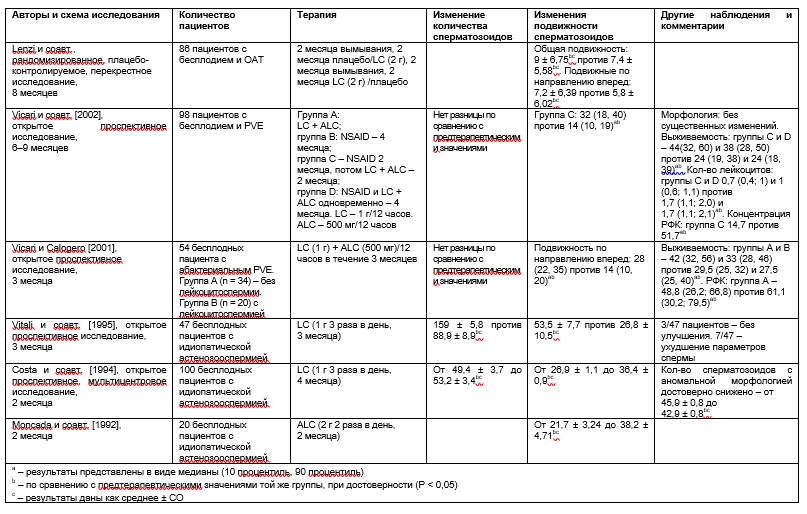
Большинство клинических исследований эффективности карнитинов не были двойными слепыми и плацебо-контролируемыми [Moncada et al., 1992; Costa et al., 1994; Vitali et al., 1995; Loumbakis et al., 1996; Vicari и Calogero, 2001; Vicari et al., 2002]. В следующем разделе собраны сведения о наиболее достоверных клинических исследованиях карнитина. Обобщение их результатов приведено в таблице 1.
L-карнитин в клинических исследованиях
Vitali и соавт. изучал эффективность перорального приема 3 г LC/день в течение 3 месяцев на 47 пациентах [Vitali et al., 1995]. Критериями включения в данное исследование были молодой возраст, бесплодие в течение, по крайней мере, 2 лет и идиопатическая астенозооспермия в качестве причины бесплодия. В конце терапевтического периода у приблизительно 80 % пациентов наблюдалось повышение уровня подвижности сперматозоидов до уровня, почти соответствующего уровню контрольной группы из 110 фертильных доноров и превышающего нижний стандарт ВОЗ. Среднее количество сперматозоидов увеличилось на 44,6 % (с 88,0 ± 8,9 × 106/мл до 159,0 ± 5,8 × 106/мл) и среднее количество подвижных сперматозоидов увеличилось на 99,6 % (с 26,8 до 53,8 %). К тому же процент сперматозоидов с быстрой подвижностью в переднем направлении также увеличился на 54,5 % (с 20,7 ± 8,7 до 32,0 ± 5,6 %). Однако, несмотря на то что данное исследование отличалось строгими критериями включения, в нем не было плацебо-группы.
В другом мультицентровом нерандомизированном, плацебо-неконтролируемом исследовании на бесплодных мужчинах с идиопатической астенозооспермией изучалось влияние долговременной (4 месяца) терапии с дозировкой LC 3 г/день на подвижность сперматозоидов [Costa et al., 1994]. Начальные параметры спермы были определены на основании двух предтерапевтических анализов на образцах спермы, протестированных на гомогенность. В случае гомогенности образцов бралось среднее из двух измерений (Т0), в случае, если образцы не были гомогенными, то бралось наибольшее из двух Т0 значений. Анализ спермы и измерение подвижности были проведены за 2 месяца до терапии, в начале терапии (Т0) и через 2 месяца после начала терапии (Т2), через 4 месяца после начала терапии (Т4) и через 2 месяца после окончания терапии (Т6). Общее количество сперматозоидов в эякуляте достоверно увеличилось к 4-му месяцу терапии (Р < 0,001). Также параллельно увеличились концентрация сперматозоидов и объем семенной жидкости. Средняя скорость была достоверно увеличена (P < 0,001) во всех временных точках после начала терапии (Т2, Т4, Т6), однако увеличение максимальной амплитуды и индекса линейности было достоверным только для Т4 и Т6.
Эффективность карнитина была также изучена в недавнем плацебо-контролируемом, рандомизированном исследовании Lenzi и соавт. на 86 пациентах. Пациенты получали 2 г LC в день или внешне неотличимое плацебо. Схема опыта предполагала двухмесячный период вымывания (без препаратов) для уменьшения эффектов спонтанной вариабельности характеристик семени, затем 2 месяца терапии/плацебо, еще 2 месяца вымывания для минимизации вероятности неправильного приписывания эффектов, 2 месяца плацебо/терапии (перекрестное исследование) и затем еще 2 месяца наблюдения.
Таблица 1. Сводная таблица по клиническим испытаниям карнитинов
(ОАТ – олигоастенозооспермия, LC – L-карнитин, ALC – L-ацетил-карнитин, PVE – простатовезикулоэпидидимит, NSAID – нестероидное противовоспалительное средство, РФК – реактивные формы кислорода)
В обеих группах (терапия и контроль) не было отмечено достоверной разницы в параметрах спермы перед терапией и не было установлено достоверных изменений в таких параметрах, как объем семенной жидкости, скорость сперматозоидов, измеренная с помощью CASA, уровень α-гликозидазы в сперме, липидный перекисный потенциал сперматозоидов и их морфология. Первый анализ различий между контрольной и терапевтической группой также не показал достоверных различий. Однако после исключения данных 5 пациентов с наименьшими значениями подвижности (10 %), у которых наблюдалось спонтанное изменение этого параметра в предтерапевтический период, различия в подвижности и подвижности в переднем направлении стали достоверными (Р = 0,04 и P = 0,05 соответственно). Концентрация сперматозоидов (Р = 0,01) и индекс линейности (Р = 0,03) также достоверно увеличивались после исключения тех же 5 пациентов. Увеличение количества сперматозоидов, подвижных в прямом направлении, было наиболее существенно у пациентов с < 5 × 106 сперматозоидов, подвижных в переднем направлении, на эякулят (55 пациентов, Р = 0,03) и 2 × 106 сперматозоидов, подвижных в переднем направлении/мл (71 пациент, Р = 0,02). Интересно, что в этом исследовании, с наилучшей схемой исследования, не было отмечено спонтанных беременностей в результате терапии [Comhaire и Mahmoud, 2003].
Клинические исследования с применением L-ацетил-карнитина
Клиническая эффективность ALC в лечении пациентов с идиопатической олигоастенозооспермией была проверена в открытом, плацебо-неконтролируемом исследовании [Moncada et al., 1992]. 20 пациентов с диагнозом «идиопатическая олигоастенозооспермия», по критериям ВОЗ, получали 4 г ALC в день в течение 60 дней. После двух месяцев терапии не было отмечено изменений в плотности, морфологии и общей подвижности сперматозоидов. Однако было отмечено 76 % увеличение количества сперматозоидов с быстрой подвижностью в прямом направлении (21,7 % ± 3,24 исходно, 38,2 ± 4,71 % к окончанию терапии). После прекращения терапии этот показатель вернулся к исходному значению. Этот феномен особо интересен, потому что произошел только после 2 месяцев терапии, тогда как считается, что для улучшения качества семени требуется постоянное воздействие карнитинов в течение полного цикла сперматогенеза (74 дня).
Заключение
Исследования показали важность LC и ALC для метаболизма сперматозоидов, а также улучшения развития и созревания сперматозоидов. ALC и LC концентрируются в придатке яичка. L-карнитин оптимизирует продукцию энергии, транспортируя длинноцепочечные жирные кислоты в митохондрии для β-окисления и регулируя соотношение ацил-КоА/КоА. L-карнитин также транспортирует избыточное количество токсичных ацильных групп из митохондрий. ALC помогает поддерживать стабильность клеточных мембран через ацетилирование мембранных фосфолипидов. ALC также участвует в сперматогенезе на уровне яичка и способствует уменьшению периода восстановления стволовых клеток после повреждения.
Была установлена связь между содержанием карнитина в сперме и уровнем ALC и LC и подвижностью сперматозоидов. Клинические испытания продемонстрировали, что карнитин улучшает параметры семени у мужчин с астено- и олигозооспермией. Однако большинство этих исследований были проведены без плацебо-контроля и не были двойными слепыми, что уменьшает достоверность результатов. К тому же, несмотря на проспективную природу клинических испытаний LC и/или ALC, даже при включении в схему эксперимента возможности плацебо-контроля и двойного слепого метода исследования, желательно установить пользу карнитина также при помощи повседневной клинической практики. Даже достоверное увеличение в характеристиках спермы не всегда приводит к клиническим улучшениям. Для оценки последних требуется установить клинически оправданную конечную точку исследования, в идеале – не ассистированное оплодотворение (также подходят успешность ЭКО, развитие эмбриона после 3-го дня, снижение раннего спонтанного прерывания беременности), для которой бы наблюдалось соответствующее улучшение, при контроле других клинических факторов, таких как возраст партнера. Требуются дополнительные клинические исследования с правильными схемами проведения эксперимента с целью дальнейшего обоснования использования карнитина для лечения мужского бесплодия, особенно у мужчин с плохим качеством спермы.
Литература
- Aitken R., Baker M., Sawyer D. Oxidative stress in the male germ line and its role in the aetiology of male infertility and genetic disease. Reproductive Biomedicine Online 2003; 7: 65–70.
- Akhondi M., Chapple С., Moore H. Prolonged survival of human spermatozoa when co-incubated with epididymal cell cultures. Human Reproduction 1997; 12: 514–522.
- Alvarez J.G. Nurture vs nature: how can we optimize sperm quality? Journal of Andrology 2003; 24: 640–648.
- Amendola R., Bartoleschi C., Cordelli E. et al. Effects of L-acetylcarnitine on the post injury recovery of mouse spermatogenesis monitored by flow cytometry, 1. Recovery after X-irradiation. Andrologia 1989; 21: 568–575.
- Amendola R., Cordelli E., Mauro F. et al. Effects of L-acetylcarnitine (LAC) on the post injury recovery of mouse spermatogenesis monitored by flow cytometry, 2. Recovery after hyperthermic treatment. Andrologia 1991; 23: 135–140.
- Arduini A. Carnitine and its асуl esters as secondary antioxidants? American Heart Journal 1992; 123: 1726–1727.
- Bahl J., Bresler R. The pharmacology of carnitine. Annual Review of Pharmacology and Toxicology 1987; 27: 257–277.
- Bartelinni M., Canale D., Izzo P. et al. L-сarnitine and acetylcarnitine in human sperm with normal and reduced motility. Acta Europaea Fertilitatis 1987; 18: 29–31.
- Bieber L. Carnitine. Annual Review of Biochemistry 1988; 57: 261–283.
- Bohnier T., Hoel P., Purvis K. et al. Carnitine levels in human accessory sex organs. Archives of Andrology 1978; 1: 53–59.
- Brooks D., Hamilton D., Mallek A. Carnitine and glycerylphosphorylcholine in the reproductive tract of the male rat. Journal of Reproduction and Fertility 1974; 36: 141–160.
- Casillas E. Accumulation of carnitine by bovine spermatozoa during maturation in epididymis. Journal of Biological Chemistry 1973; 248: 8227–8232.
- Cayli S., Jakab A., Ovari L. et al. Biochemical markers of sperm function: male fertility and sperm selection for ICSI. Reproductive BioMedicine Online 2003; 7: 462–468.
- Comhaire F., Mahmoud A. The role of food supplements in the treatment of the infertile man. Reproductive BioMedicine Online 2003; 7: 385–391.
- Comhaire F., Monteyne R., Kunnen M. The value of scrotal thermography as compared with selective retrograde venography on the internal spermatic vein for the diagnosis of subclinical varicocle. Fertility and Sterility 1976; 27: 694–698.
- Cooper T., Yeung C. Approaches to post-testicular contraception. Asian Journal of Andrology. 1999; 1: 29–36.
- Cooper T., Yeung C., Nashan D. et al. Epididymal markets in human infertility. Journal of Andrology 1988; 9: 91–101.
- Cooper T., Weidner W., Nieschlag E. The influence of inflammation of the human male genital tract on secretion of the seminal markers alpha-glucosidase, glycerophosphocholine, carnitine, fructose and citric acid. International Journal of Andrology 1990; 13: 329–336.
- Costa M., Canule D., Filicori M. et al. L-сarnitine in idiopathic asthenozoospermia: a multicenter study. Andrologia 1994; 26: 155–159.
- Deana R., Indino M., Rigoni F. et al. Effect of t-carnitine on motility and acrosome reaction of human spermatozoa, Achives of Andrology 1988; 21: 147–153.
- Deana R., Rigoni F., Francesconi M. et al. Effect of L-carnitine and l -aminocarnitine on calcium transport, motility and enzyme release from ejaculated bovine spermatozoa. Biology of Reproduction 1989; 41: 949–955.
- Duru N., Morshedi M., Schuffner A. et al. Semen treatment with progesterone and/or acetyl-l-carnitine does not improve sperm motility or membrane damage after cryopreservation-thawing. Fertility and Sterility 2000; 74: 715–720.
- Engle A., Rebouche C. Carnitine metabolism and inborn errors. Journal of Inherited metabolic Disease 1984; 7: 38–43.
- Enomoto A., Wempe M., Tsuchida H. et al. Molecular identification of a novel carnitine transporter specific to human testis. Insights into the mechanism of carnitine recognition. Journal of Biological Chemistry 2002; 277: 36262–36271.
- Frenkel G., Peterson R., Davis J. et al. Glycerylphosphorycholine and carnitine in normal human semen and in postvasectomy semen: differences in concentrations. Fertility and Sterility 1974; 25: 84–87.
- Golan R., Weissenberg R., Lewin L. Carnitine and acetylcarnitine in motile and immotile spermatozoa. International Journal of Andrology 1984; 7: 484–494.
- Grizard G., Vignon N., Boucher D. Changes in carnitine and acetycarnitine in human semen during cryopreservation. Human Reproduction 1992; 7: 1245–1248.
- Hinton B., Snoswell A., Stechell B. The concetration of carnitine in the luminal fluid of the testis and epididymis of the rat and some other mammals. Journal of Reproduction and Fertility 1979; 56: 105–111.
- Jenkins D., Griffith O. Antiketogenic and hypoglycemic effects of aminocairntine and acetylaminocarnitine. Proceedings of the National Academy of Sciences of the United States of America 1986; 83: 290–294.
- Jeulin C., Lewin L. Role of free 1-carnitine and acetyl-l-carnitine in post-gonadal maturation of mammalian spermatozoa. Human Reproduction Update 1996; 2: 87–102.
- Jeulin C., Soufir J., Marson J. et al. The distribution of carnitine and acetylcarnitine in the epididymis and epididymal spermatozoa of the boar. Journal of Reproduction and Fertility 1987; 79: 523–529.
- Johansen L., Bohmer T. Motility related to the presence of carnitine/acetyl-l-carnitine in human spermatozoa. International Journal of Andrology 1979; 202–210.
- Kohengkul S., Tanphaichitr N., Muangmun V. et al. Levels of l-carnitine and l- acetylcarnitine in normal and infertile human semen: a lower level of l-acetylcarnitine in infertile semen. Fertility and Sterility 1977; 28: 1333–1336.
- Lay M., Richardson E., Boone W. et al. Seminal plasma and IVF potential. Journal of Assisted Reproduction and Genetics 2001; 18: 144–150.
- Lenzi A., Lombardo F., Sgro P. et al. Use of carnitine therapy in selected cases of male factor infertility: a double-blind crossover trial. Fertility and Sterility 2003; 2: 292–300.
- Lewin M., Beer R., Lunenfeld B. Epididymis and seminal vesicle as sources of carnitine in human seminal fluid: the clinical significance of the carnitine concentration in human seminal fluid. Fertility and Sterility 1976; 27: 9–13.
- Loumbakis P., Anezinis P., Avengeliou A. et al. Effect of l-carnitine in patients with asthenozoospermia. European Urology 1996; 30: 255.
- Marquis N., Fritz I. Effects of testosterone on the distribution of carnitine, acetylcarnitine and carnitineacetyltransferase in tissues of the reproductive system of the male rat. Journal of Biological Chemistry 1965; 246: 2197–3001.
- Matalliotakis I., Youmantaki Y., Evageliou A. et al. L-Carnitine levels in the seminal plasma of fertile and infertile men: correlation with sperm quality. International Journal of Fertility 2000; 45: 236–240.
- Menchini-Fabris F., Canale D., Izzo P. et al. Free r-carnitine in human semen; its variability in different andrologic pathologies. Fertility and Sterility 1984; 42: 263–267.
- Mieusset R., Parinaud J., Chap H. et al. Absence of correlation between the levels of ATP and other seminal compounds in semen and the results of human in-vitro fertilization. International Journal of Andrology 1989; 12: 346–353.
- Moncada M., Vicari E., Cimino C. et al. Effect of acetylcarnitine in oligoasthenospermic patients. Acta Europea Fertilitatis 1992; 23: 221–224.
- Moore H. Contribution of epididymal factors to sperm maturation and storage. Andrologia 1998; 30: 223–229.
- Ochendorf F. Infections in the male genital tract and reactive oxygen species. Human Reproduction Update 1999; 5: 399–420.
- Palmero S., Bottazzi C., Costa M. et al. Metabolic effects of l-carnitine on prepubertal rat Sertoli cells. Hormone and Metabolic Research 2000; 32: 87–90.
- Pignatelli P., Lenti L., Sanguigni et al. Carnitine inhibits arachidonic acid turnover, platelet function, and oxidative stress. American Journal of Physiology. Heart an
Источник изображений на данной странице – Shutterstock / Fotodom.
