О.А. Пустотина

ЧОУ ДПО «Академия медицинского образования им. Ф.И. Иноземцева», Санкт-Петербург, Россия
Инсулинорезистентность (ИР) является триггером большинства патогенетических изменений при синдроме поликистозных яичников (СПКЯ). В реализации эффектов инсулина активное участие принимают стереоизомеры инозитола – мио-инозитол (МИ) и Д-хиро-инозитол (ДХИ). Соотношение МИ и ДХИ варьирует в зависимости от метаболических потребностей ткани и находится под строгим контролем инсулина. В плазме крови соотношение МИ/ДХИ составляет 40:1, тогда как в фолликулярной жидкости – 100:1. У женщин с СПКЯ и ИР концентрация ДХИ в чувствительных к инсулину тканях (мышцы, мозг, сердце, жировая ткань) резко снижается, что может быть обусловлено как недостатком общего потребления инозитола, так и нарушением экспрессии/синтеза эпимеразы, конвертирующей МИ в ДХИ. Яичники, наоборот, на избыток инсулина отвечают чрезмерной эпимеризацией МИ в ДХИ и снижением соотношения МИ/ДХИ в фолликулярной жидкости до 0,2:1. Экспериментальные и клинические исследования показали, что МИ в сочетании с ДХИ в соотношении 40:1, соответствующем физиологическому содержанию в плазме крови, является наиболее оптимальной терапевтической схемой для восстановления метаболических, гормональных и репродуктивных нарушений у женщин с СПКЯ. Регуляция метаболизма глюкозы происходит также независимо от инозитола, путем эндогенной альфа-липоевой кислоты (АЛК), синтезируемой в митохондриях.
Заключение. Дополнительный прием АЛК с инозитолом улучшает чувствительность к инсулину и репродуктивную функцию у женщин с СПКЯ, особенно при ожирении и наследственной предрасположенности к сахарному диабету. Таким образом, сочетание АЛК с МИ и ДХИ создает новую комплексную стратегию по преодолению ИР и ее последствий у женщин с СПКЯ.
Ключевые слова: мио-инозитол, Д-хиро-инозитол, альфа-липоевая кислота, инсулинорезистентность, ожирение, синдром поликистозных яичников.
Синдром поликистозных яичников (СПКЯ) включает в себя три хорошо известных критерия, определенных на Роттердамской консенсусной конференции: олиго- или ановуляцию, клинический или биохимический гиперандрогенизм и мультифолликулярные (поликистозные) яичники [1]. В последние годы установлен и четвертый критерий, встречающийся примерно у 70% женщин с избыточной массой тела и у 15–30% худощавых женщин с диагнозом СПКЯ [1, 2] – это инсулинорезистентность (ИР).
ИР и связанная с ней компенсаторная гиперинсулинемия считаются основными триггерами большинства патогенетических изменений при СПКЯ, поскольку избыток инсулина в крови нарушает секрецию гонадотропинов, повышая уровень лютеинизирующего гормона (ЛГ), усиливает индуцированную ЛГ продукцию андрогенов яичниками, а также подавляет активность ароматазы, конвертирующей андрогены в эстрогены в жировой ткани и тека-клетках яичников. Кроме того, гиперинсулинемия активирует синтез андрогенов надпочечниками, ингибирует образование в печени глобулина, связывающего половые гормоны (ГСПГ), и увеличивает фракцию свободных андрогенов, усиливая симптомы гиперандрогенизма. С гиперсекрецией инсулина также снижается чувствительность ткани яичников к действию фолликулостимулирующего гормона (ФСГ), что ингибирует фолликулогенез и созревание ооцитов и приводит к нарушению менструального цикла, ановуляции и бесплодию [3, 4]. Основными мессенджерами инсулина в клетках являются стереоизомеры инозитола – мио-инозитол (МИ) и Д-хиро-инозитол (ДХИ), в последние годы широко используемые для лечения ИР у женщин с СПКЯ [5–9].
Физиологическая роль инозитоловв организме
Инозитол входит в состав фитиновой кислоты и ее солевых производных (фитатов), содержащихся в семенах злаковых, бобовых и масличных культур, и представлен в природе 9 стереоизомерами. Наиболее биологически важным считается МИ, небольшое количество которого синтезируется и в организме человека (печени, почках, яичках, молочной железе и мозге) [10–12]. Предшественником МИ является глюкозо-6-фосфат, входящий в состав фосфолипидов клеточных мембран. Внутриклеточный синтез МИ активируется после связывания инсулина со своими рецепторами на поверхности клеточной мембраны, и затем трансформация МИ идет двумя путями (рисунок). Один путь приводит к образованию МИ-содержащих инозитол-фосфогликанов (МИ-ИФГ), опосредующих поступление глюкозы в клетку через активацию транспортера GLUT4 в клеточной мембране [8]. Также МИ через фактор транскрипции рецепторов PPAR-gamma в адипоцитах участвует в регуляции углеводного обмена [13] и влияет на кишечную абсорбцию глюкозы [14]. Второй путь преобразования МИ происходит с участием фермента эпимеразы, в результате которого образуется другой изомер инозитола – ДХИ. ДХИ-содержащие инозитол-фосфогликаны (ДХИ-ИФГ) стимулируют гликогенсинтазу в цитоплазме клеток и накопление гликогена, а также через митохондриальную пируватдегидрогеназу способствуют включению глюкозы в цикл Кребса с образованием аденозинтрифосфорной кислоты [15, 16]. Для обеспечения передачи сигналов инсулина необходимо как адекватное потребление инозитола с пищей, так и определенное равновесие между МИ и ДХИ внутри клетки, определяемое метаболической активностью органа или ткани [6, 12, 17, 18]. Так, МИ стимулирует клеточное поглощение глюкозы и поэтому в большом количестве содержится в органах с высоким энергетическим потреблением, таких как мозг, сердце и яичники. Например, в фолликулярной жидкости соотношение МИ к ДХИ составляет 100:1 [19], при физиологическом соотношении в плазме крови – 40:1 [18]. ДХИ действует как промоутер хранения глюкозы в виде гликогена и индуктор ее окислительного использования на уровне митохондрий для производства энергии, поэтому концентрации ДХИ высоки в тканях, депонирующих гликоген (печень, жировая ткань, мышцы), и низки в активно использующих глюкозу [6, 12].
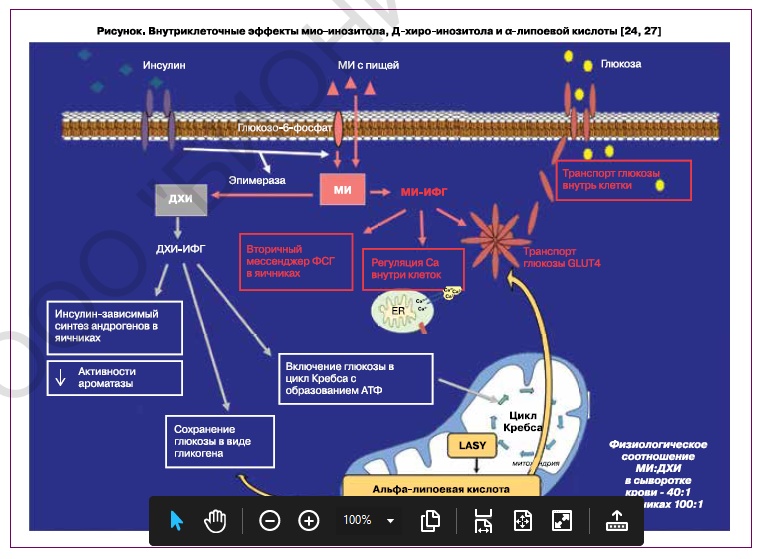
Конвертация МИ в ДХИ обусловлена инсулинзависимым ферментом эпимеразой, биоактивность которой при возникновении ИР резко снижается, что вызывает дефицит образования ДХИ [12, 20]. При обследовании больных сахарным диабетом или СПКЯ наблюдаются более низкие концентрации ДХИ в чувствительных к инсулину тканях и органах, таких как почки, печень и мышцы, при экскреции с мочой при относительно стабильном или несколько повышенном уровне МИ [16, 20]. Одним из предполагаемых путей нарушения сигнальной активности инсулина является нарушение внутриклеточного баланса стереоизомеров инозитола в результате генетически детерминированной недостаточности эпимеразы, что подтверждается увеличением отношения МИ к ДХИ не только у больных сахарным диабетом 1-го и 2-го типов, но и у их здоровых родственников [20].
Также было выявлено, что биологические эффекты инсулина опосредуются не только ИФГ и активностью эпимеразы, но и независимо от них – альфа-липоевой кислотой (АЛК), синтезируемой внутри митохондрий. АЛК является кофактором митохондриальных ферментных комплексов и, кроме мощного антиоксидантного действия [21, 22], обеспечивает поглощение глюкозы клетками, активируя GLUT-4 подобно МИ [21, 23]. Эндогенный синтез АЛК происходит при участии синтазы липоевой кислоты (LASY), экспрессия которой у больных сахарным диабетом часто понижена [21]. В результате недостаток АЛК, так же как и МИ, нарушает поступление глюкозы в клетки и индуцирует системную ИР. При комбинации дефектов экспрессии/синтеза эпимеразы и LASY риск развития компенсаторной гиперинсулинемии и в дальнейшем сахарного диабета еще больше повышается [24].
Применение инозитола при синдроме поликистозных яичников
В многочисленных исследованиях показано, что применение добавок МИ и/или ДХИ увеличивает внутриклеточное высвобождение фосфогликанов инозитола и сопровождается снижением уровня инсулина и индекса HOMА в крови. Восстановление чувствительности тканей к инсулину при приеме инозитола является ключевым звеном в улучшении гормональных, антропометрических и метаболических показателей при заболеваниях, обусловленных ИР, таких как СПКЯ, метаболический синдром и сахарный диабет II типа [5, 24–29].
Помимо реализации метаболических эффектов инсулина, стереоизомеры инозитола играют специфическую роль на уровне яичников. Так, ДХИ как вторичный мессенджер инсулина напрямую стимулирует биосинтез тестостерона тека-клетками [30], а также путем подавления экспрессии ароматазы препятствует его конвертации в эстроген [31]. Потребность яичников в МИ значительно выше, чем в ДХИ, так как он одновременно является вторичным мессенджером ФСГ и потому принимает непосредственное участие в фолликуло- и оогенезе [32]. Дополнительный прием МИ и/или ДХИ в течение 3–6 месяцев достоверно улучшает функцию яичников, восстанавливает овуляторный менструальный цикл, снижает биомаркеры оксидативного стресса, а также нормализует гормональные и метаболические показатели у женщин с СПКЯ [33–36]. При этом, в отличие от метформина, широко используемого у женщин с СПКЯ, инозитол не вызывает никаких побочных эффектов [37–39] и снижает показатели тревожности и депрессии [36]. По заключению экспертов [28, 40], использование обоих стереоизомеров инозитола в программах вспомогательных репродуктивных технологий улучшает качество ооцитов и эмбрионов, снижает суммарную дозу ФСГ, продолжительность протоколов стимуляции и может рекомендоваться в качестве адъювантной терапии при бесплодии у женщин с СПКЯ.
Однако всесторонний обзор лечения бесплодия инозитолами у пациентов с СПКЯ А. Gateva et al., опубликованный в 2018 г. [41], показал неоднородные результаты. В частности, сравнение эффектов МИ и ДХИ в циклах ЭКО [42] обнаружило, что, несмотря на отсутствие различий в общем количестве ооцитов, полученных в результате стимуляции, число зрелых ооцитов, эмбрионов высшего качества и частота наступления беременности были значительно выше в группе женщин, получавших добавки МИ по сравнению с теми, кто принимал ДХИ. Isabella R. и Raffone E. [43] показали, что с увеличением дозы ДХИ при сочетанном приеме с МИ качество ооцитов и эмбрионов прогрессивно ухудшается. Увеличение уровня ДХИ также ингибирует абсорбцию МИ в кишечнике за счет конкурентного связывания с единым транспортером, имеющим большее сродство к ДХИ, чем к МИ [44]. В то же время прием только МИ, как продемонстрировал А.Genazzani et al. [45], тоже не у всех пациенток с СПКЯ приводит к существенным метаболическим изменениям. Наиболее частые неудачи наблюдались у женщин, имевших ближайших родственников с сахарным диабетом [46]. Это может свидетельствовать о том, что компенсаторная гиперинсулинемия, возникающая вследствие ИР, не всегда устраняется введением МИ, так как может быть связана не только с пищевым дефицитом инозитола, но и с генетически детерминированным нарушением экспрессии/синтеза эпимеразы и снижением эндогенной конверсии МИ в ДХИ в чувствительных к инсулину органах и тканях [47]. В этих случаях применение ДХИ позволяет восстановить баланс инозитолов в клетке и повысить чувствительность к инсулину, независимо от семейного анамнеза [48, 49].
Применение мио-инозитола и Д-хиро-инозитола в соотношении 40:1 у женщин с синдромом поликистозных яичников
Как стало известно в последние годы, яичники, в отличие от других органов и тканей (мышцы, печень, жировая ткань), всегда сохраняют нормальную чувствительность к инсулину, даже при наличии системной ИР. На переизбыток инсулина они отвечают повышением активности эпимеразы в текаклетках и увеличением конвертации МИ в ДХИ. В результате дисбаланс инозитолов в фолликулярной жидкости у больных СПКЯ идет в противоположном направлении, наблюдаемом в ИР-тканях, и характеризуется специфическим истощением МИ и перегрузкой ДХИ со снижением соотношения МИ/ДХИ до 0,2:1 [15, 19]. С дефицитом МИ снижается ФСГ-сигнализации в клетках гранулезы яичников, подавляются фолликулогенез и созревание яйцеклеток [19, 25]. Характерная для СПКЯ гиперандрогения является следствием как снижения стимулирующего влияния ФСГ на активность ароматазы, конвертирующей андрогены в эстрогены, так и дополнительного блокирования ее функции высокими концентрациями ДХИ [15, 19, 31, 50, 51]. Также ДХИ как вторичный мессенджер инсулина непосредственно стимулирует биосинтез тестостерона тека-клетками, уровень которого более чем в 4 раза превышает показатель у здоровых женщин [30]. Недавнее исследование К. Ravanos et al. [51] впервые показало, что повышение содержания ДХИ в фолликулярной жидкости дозозависимо снижает качество бластоцист. При этом высокая концентрация МИ, наоборот, ассоциирована со зрелостью фолликула и может быть потенциальным маркером хорошего качества ооцитов и эмбрионов [27].
Таким образом, яичники у женщин с СПКЯ характеризуются не только снижением общего количества инозитолов, но и индуцированной инсулином чрезмерной эпимеризацией МИ в ДХИ. Поэтому для их нормального функционирования необходимо восстановление физиологических уровней обоих стереоизомеров инозитола [6, 7, 12, 18, 27]. В 2019 г. А. Bevilacqua et al. [52] впервые предоставили доказательства разной эффективности, оказываемой различными соотношениями MИ/ДХИ (5:1; 20:1; 40:1; 80:1) при СПКЯ. Самок мышей подвергали непрерывному воздействию света в течение 10 недель для формирования андрогенного фенотипа яичников с выраженной гипертрофией слоя тека-клеток. Последующее ежедневное лечение МИ/ДХИ в молярном соотношении 40:1 привело к быстрому и почти полному исчезновению гистологических признаков и клинических симптомов СПКЯ. Другие коэффициенты МИ/ДХИ были менее эффективными, а высокое содержание ДХИ вызвало негативные последствия. Полученные данные полностью подтвердились в клиническом исследовании М. Nordio et al. [53]. Семь групп женщин с СПКЯ получали 2 г инозитола 2 раза в сутки в соотношениях МИ к ДХИ 0:1, 1:3,5; 2,5:1; 5:1; 20:1; 40:1 и 80:1. Через 3 месяца лечения сывороточные уровни ЛГ, эстрадиола, прогестерона и ГСПГ полностью нормализовались только у женщин, получавших МИ/ДХИ в соотношении 40:1, и у 62,5% восстановился овуляторный менструальный цикл. Соотношения МИ/ДХИ 5:1, 20:1 и 80:1 индуцировали овуляцию у 12,5, 37,5 и 50% соответственно, а при более высоких концентрациях ДХИ овуляция вообще не наступала. При этом улучшение индекса НОМА во всех группах было одинаковым, что продемонстрировано и в других исследованиях [41]. Также было показано, что дополнительный прием 1100 мг МИ и 27,6 мг ДХИ в день не только снижает ИР, улучшает гормональный статус и восстанавливает овуляцию [54, 55], но и помогает быстрее снизить индекс массы тела у женщин с СПКЯ и ожирением [55]. Комбинированная терапия МИ и ДХИ в соотношении 40:1 в протоколе стимуляции овуляции у женщин с СПКЯ значительно улучшает качество яйцеклеток и эмбрионов, а также частоту наступления беременности в сравнении с приемом только ДХИ [56]. Согласно консенсусному заключению «The Expert Group on Inositol», опубликованному в 2020 г. [27], восстановление физиологического баланса между концентрациями МИ и ДХИ в фолликулярной жидкости является важным фактором в нормализации функции яичников и преодолении бесплодия у женщин с СПКЯ. Наилучшая клиническая эффективность достигается с помощью приема МИ в сочетании с ДХИ в молярном соотношении 40:1. Эксперты рекомендуют избегать эксклюзивных добавок ДХИ при СПКЯ, потому что высокие дозы ДХИ вредны для яичников и созревания яйцеклеток.
Применение мио-инозитола и Д-хиро-инозитола в сочетании с альфа-липоевой кислотой у женщин с синдромом поликистозных яичников
Как было показано ранее, метаболизм глюкозы в клетках регулируется двумя независимыми путями: посредством фосфогликанов инозитола и митохондриальной АЛК. Вследствие этого ИР и компенсаторная гиперинсулинемия у женщин с СПКЯ могут возникать не только при недостаточном потреблении инозитола или нарушении экспрессии/синтеза эпимеразы, вызывающем внутриклеточный дисбаланс МИ и ДХИ, но и в результате недостаточности фермента LASY, отвечающего за синтез эндогенной АЛК [21, 56, 57]. Исходя из этого, АЛК также рассматривается как терапевтическое средство при эндокринных заболеваниях, обусловленных ИР [23, 58, 59], особенно у женщин с ожирением и семейным диабетом [60]. Действительно, у всех женщин с ожирением и СПКЯ при дополнительном приеме АЛК в течение 3 месяцев значительно улучшились такие метаболические параметры, как инсулин, С-пептид и индекс НОМА [60, 61]. Более того, у пациенток с наследственной предрасположенностью к диабету и имеющих повышенный риск неалкогольного жирового гепатоза также нормализовались повышенные уровни АЛТ и АСТ, что свидетельствовало о положительном влиянии АЛК на функцию печени [60, 62]. Сочетанное применение АЛК с инозитолом (МИ и/или ДХИ) у женщин с СПКЯ значительно улучшало чувствительность к инсулину [62, 63] и репродуктивную функцию [23, 63, 64], независимо от наследственной предрасположенности к сахарному диабету, в том числе в случаях неэффективности изолированных добавок инозитола [62, 65]. С учетом вышеизложенного, применение комбинированной добавки к пище, содержащей в 1 таблетке 563,8 мг инозитола в соотношении МИ/ДХИ 40:1, 37,5 мг АЛК в сочетании с 200 МЕ витамина Д, 300 мкг фолиевой кислоты и 2,5 мг марганца, зарегистрированной в нашей стране как «Дифертон», может иметь гораздо более значимые клинические эффекты у женщин с СПКЯ, чем прием только инозитола, при дозировке 2 таблеток в день.
Заключение
Таким образом, имеющиеся в настоящее время данные подтверждают важную роль ИР в патогенезе СПКЯ. Инозитол является сенсибилизатором инсулина и с помощью своих стереоизомеров реализует его различные эффекты. Так, МИ стимулирует клеточное поглощение глюкозы, участвует в регуляции углеводного обмена, а также является вторичным мессенджером ФСГ в яичниках. ДХИ, образующийся в результате трансформации МИ, обеспечивает сохранение глюкозы в виде гликогена, ее участие в энергообразовании, а также влияет на стероидогенез. Соотношение МИ и ДХИ варьирует в зависимости от метаболических потребностей ткани и находится под строгим контролем инсулина. В плазме крови соотношение МИ/ДХИ составляет 40:1, тогда как в фолликулярной жидкости – 100:1. У женщин с СПКЯ и ИР концентрация ДХИ в чувствительных к инсулину тканях (мышцы, мозг, сердце, жировая ткань) резко снижается, что может быть обусловлено как недостатком общего потребления инозитола, так и генетически детерминированным нарушением экспрессии/синтеза эпимеразы, конвертирующей МИ в ДХИ. Яичники, в отличие от чувствительных к инсулину органов и тканей, не бывают инсулинорезистентными и на избыток инсулина отвечают чрезмерной эпимеризацией МИ в ДХИ, снижая соотношение МИ/ДХИ в фолликулярной жидкости до 0,2:1. Экспериментальные и клинические исследования показали, что МИ в сочетании с ДХИ в соотношении 40:1, соответствующем физиологическому содержанию в плазме крови, является наиболее оптимальной терапевтической схемой для восстановления метаболических, гормональных и репродуктивных нарушений у женщин с СПКЯ. Помимо инозитола, клеточный метаболизм глюкозы регулируется другим независимым путем – посредством АЛК, синтезируемой в митохондриях. Поэтому ИР и компенсаторная гиперинсулинемия у женщин с СПКЯ могут возникать не только при недостаточном потреблении инозитола и/или внутриклеточном дисбалансе МИ и ДХИ, но и в результате недостаточного синтеза эндогенной АЛК.
Таким образом, ИР, лежащая в основе большинства патогенетических изменений при СПКЯ, представляет сложную интерактивную модель, отражающую необходимость как достаточного потребления инозитола с сохранением физиологического равновесия между двумя его изомерами, так и восполнения возможного дефицита эндогенной АЛК. Данные знания расширяют наше понимание проблемы ИР и диктуют необходимость дальнейших исследований в поисках наиболее оптимальной тактики ведения женщин с СПКЯ.
Литература
- Teede H.J., Misso M.L., Costello M.F., Dokras A., Laven J., Moran L., Piltonen T., Norman R.J. et al. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Hum Reprod. 2018; 33(9): 1602-18.
- Genazzani A.D., Ricchieri F., Lanzoni C. Use of metformin in the treatment of polycystic ovary syndrome. Womens Health (Lond). 2010; 6(4): 577-93.
- De Leo V., Musacchio M.C., Cappelli V. et al. Genetic, hormonal and metabolic aspects of PCOS: an update. Reprod Biol Endocrinol. 2016; 14(1): 38.
- Behboudi-Gandevani S., Tehrani F.R., Dovom M.R., Farahmand M., Khomami M.B., Noroozzadeh M., Kabir A., Azizi F. Insulin resistance in obesity and polycystic ovary syndrome: systematic review and meta-analysis of observational studies. Gynecol Endocrinol. 2016; 32(5): 343-53.
- Michell R.H. Do inositol supplements enhance phosphatidylinositol supply and thus support endoplasmic reticulum function? Br J Nutr. 2018;1-16.
- Bizzarri M., Fuso A., Dinicola S., Cucina A., Bevilacqua A. Pharmacodynamics and pharmacokinetics of inositol(s) in health and disease. Expert Opin Drug Metab Toxicol. 2016;12(10):1181-96.
- Lagana A.S., Garzon S., Casarin J., Franchi M., Ghezzi F. Inositol in polycystic ovary syndrome: restoring fertility through a pathophysiology-based approach. Trends Endocrinol Metab. 2018; 29(11): 768-80.
- Nestler J.E. Unfer V. Reflections on inositol(s) for PCOS therapy: steps toward success. Gynecol Endocrinol. 2015; 31(7): 501-5.
- Вартанян Э.В., Цатурова К.А., Девятова Е.А., Михайлюкова А.С., Левин В.А., Петухова Н.Л., Маркин А.В., Степцова Е.М. Резервы улучшения качества ооцитов при синдроме поликистозных яичников. Проблемы репродук- ции. 2017; 23(3): 50-4.
- Parthasarathy R., Eisenberg F.Jr. The inositol phospholipids: a stereochemical view of biological activity. Biochem J. 1986; 235(2): 313-22.
- Bizzarri M., Carlomagno G. Inositol: history of an effective therapy for polycystic ovary syndrome. Eur Rev Med Pharmacol Sci. 2014;18:1896-903.
- Bevilacqua A., Bizzarri M. Inositols in insulin signaling and glucose metabolism. Int. J. Endocrinol. 2018; 2018: 1968450.
- Lagana A.S., Vitale S.G., Nigro A., Sofo V., Salmeri F.M. et al. Pleiotropic actions of peroxisome proliferator-activated receptors (PPARs) in dysregulated metabolic homeostasis, inflammation and cancer: current evidence and future perspectives. Int J Mol Sci. 2016; 17(7): 999.
- Chukwuma C.I., Ibrahim M.A., Islam M.S. Myo-inositol inhibits intestinal glucose absorption and promotes muscle glucose uptake: a dual approach study. J Physiol Biochem. 2016;72 (4):791–801. doi: 10.1007/s13105-016-0517-1.
- Heimark D., McAllister J., Larner J. Decreased myo-inositol to chiroinositol (M/C) ratios and increased M/C epimerase activity in PCOS theca cells demonstrate increased insulin sensitivity compared to controls. Endocr J. 2014; 61(2): 111-7.
- Larner J. D-chiro-inositol – its functional role in insulin action and its deficit in insulin resistance. Int. J. Exp. Diabetes Res. 2002; 3(1): 47-60.
- Monastra G., Unfer V., Harrath A.H., Bizzarri M. Combining treatment with myo-inositol and D-chiro-inositol (40:1) is effective in restoring ovary function and metabolic balance in PCOS patients. Gynecol Endocrinol. 2017; 33(1): 1-9.
- Facchinetti F., Dante G., Neri I. The ratio of MI to DCI and its impact in the treatment of polycystic ovary syndrome: experimental and literature evidences.Front Gynecol Endocrinol. 2016; 3: 103-9.
- Unfer V., Carlomagno G., Papaleo E., Vailati S., Candiani M., Baillaargeon J.-P. Hyperinsulinemia alters myoinositol to d-chiroinositol ratio in the follicular fluid of patients with PCOS. Reprod Sci. 2014; 21(7): 854-8.
- Larner J., Brautigan D.L., Thorner M.O. D-chiro-inositol glycans in insulin signaling and insulin resistance. Mol Med. 2010; 16(11-12): 543-52.
- Padmalayam I., Hasham S., Saxena U., Pillarisetti S. Lipoic acid synthase (LASY): a novel role in inflammation, mitochondrial function, and insulin resistance. Diabetes. 2009; 58(3): 600-8.
- Smith A.R., Shenvi S.V., Widlansky M., Suh J.H., Hagen T.M. Lipoic acid as a potential therapy for chronic diseases associated with oxidative stress. Curr Med Chem. 2004; 11(9): 1135-46.
- Masharani U., Gjerde C., Evans J.L., Youngren J.F., Goldfine I.D. Effects of controlled-release alpha lipoic acid in lean, nondiabetic patients with polycystic ovary syndrome. J Diabetes Sci Technol. 2010; 4(2): 359-64.
- Genazzani A.D. Expert’s opinion: integrative treatment with inositols and lipoic acid for insulin resistance of PCOS. Gynecol Reprod Endoc Metabolism. 2020;1(3):146-57.
- Unfer V., Orru B., Monastra G. Inositols: from physiology to rational therapy in gynecological clinical practice. Expert Opin Drug Metab Toxicol 2016; 12(10): 1129-31.
- Facchinetti F., Bizzarri M., Benvenga S., D’Anna R., Lanzone A. et al. Results from the International Consensus Conference on Myo-inositol and d-chiroinositol in Obstetrics and Gynecology: the link between metabolic syndrome and PCOS. Eur J Obstet Gynecol Reprod Biol. 2015; 195: 72-6.
- Facchinetti F., Appetecchia M., Aragona C., Bevilacqua A., Espinola M.S.B. et al. Experts’ opinion on inositols in treating polycystic ovary syndrome and noninsulin dependent diabetes mellitus: a further help for human reproduction and beyond. Expert Opin Drug Metab Toxicol. 2020; 16(3): 255-74.
- Bevilacqua A., Carlomagno G., Gerli S., Oliva M.M., Devroey P. et al. Results from the international consensus conference on myo-inositol and d-chiroinositol in obstetrics and gynecology–assisted reproduction technology. Gynecol Endocrinol. 2015; 31(6): 441-6.
- Vitagliano A., Saccone G., Cosmi E., Visentin S., Dessole F., Ambrosini G., Berghella V. Inositol for the prevention of gestational diabetes: a systematic review and meta-analysis of randomized controlled trials. Arch Gynecol Obstet. 2019; 299 (1): 55-68.
- Nestler J.E., Jakubowicz D.J., de Vargas A.F., Brik C., Medina F. Insulin stimulates testosterone biosynthesis by human thecal cells from women with polycystic ovary syndrome by activating its own receptor and using inositolglycan mediators as the signal transduction system. J Clin Endocrinol Metab. 1998; 83(6): 2001-5.
- Sacchi S., Marinaro F., Tondelli D., Lui J., Xella S. et al. Modulation of gonadotrophin induced steroidogenic enzymes in granulosa cells by d-chiroinositol. Reprod Biol Endocrinol. 2016; 14(1): 52.
- Milewska E.M., Czyzyk A., Meczekalski B., Genazzani A.D. Inositol and human reproduction. From cellular metabolism to clinical use. Gynecol Endocrinol. 2016; 32(9): 690-5.
- Zeng L., Yang K. Effectiveness of myoinositol for polycystic ovary syndrome: a systematic review and meta-analysis. Endocrine. 2018; 59(1): 30-8.
- Pundir J., Psaroudakis D., Savnur P., Bhide P., Sabatini L. et al. Inositol treatment of anovulation in women with polycystic ovary syndrome: a meta-analysis of randomised trials. BJOG. 2018; 125 (3): 299-308.
- Unfer V., Facchinetti F., Orru B., Giordani B., Nestler J. Myo-inositol effects in women with PCOS:a meta-analysis of randomized controlled trials. Endocr Connect. 2017; 6(8): 647-58.
- Воронцова А.В., Гаспарян С.А., Громова О.А., Джобава Э.М., Киселева Е.Ю., Коротких И.Н., Кулешов В.М., Обоскалова Т.А., Пустотина О.А., Сахаутдинова И.В., Спиридонова Н.В., Тапильская Н.И., Тхостова Е.Б. Заключение совещания экспертов «Обоснование применения средств на основе инозитола у пациенток с нарушениями менструального цикла» // Проблемы репродукции. 2020; 26(1): 44-54.
- Jamilian H., Jamilian M., Foroozanfard F., Ebrahimi F.A., Bahmani F.,Asemi Z. Comparison of myo-inositol and metformin on mental health parameters and biomarkers of oxidative stress in women with polycystic ovary syndrome: a randomized, double-blind, placebo-controlled trial. J Psychosom Obstet Gynaecol. 2018; 39(4): 307-4.
- Shokrpour M., Foroozanfard F., Ebrahimi F.A., Vahedpoor Z., Aghadavod E., Ghaderi A., Asemi Z. Comparison of myo-inositol and metformin on glycemic control, lipid profiles, and gene expression related to insulin and lipid metabolism in women with polycystic ovary syndrome: a randomized controlled clinical trial. Gynecol. Endocrinol. 2019; 35(5): 406-11.
- Facchinetti F., Orru B., Grandi G., Unfer V. Short-term effects of metformin and myo-inositol in women with polycystic ovarian syndrome (PCOS): a metaanalysis of randomized clinical trials. Gynecol Endocrinol. 2019; 35(3): 198-206.
- Lagana A.S., Vitagliano A., Noventa M., Ambrosini G., D’Anna R. Myo-inositol supplеmentation reduces the amount of gonadotropins and length of ovarian stimulation in women undergoing IVF: a systematic review and meta-analysis of randomized controlled trials. Arch Gynecol Obstet. 2018; 298(4): 675-84.
- Gateva A., Unfer V., Kamenov Z. The use of inositol(s) isomers in the management of polycystic ovary syndrome: a comprehensive review. Gynecol Endocrinol. 2018; 34(7): 545-50.
- Unfer V., Carlomagno G., Rizzo P., Raffone E., Roseff S. Myo-inositol rather than D-chiro-inositol is able to improve oocyte quality in intracytoplasmic sperm injection cycles. A prospective, controlled, randomized trial. Eur Rev Med Pharmacol Sci. 2011; 15(4): 452-7.
- Isabella R., Raffone E. CONCERN: Does ovary need D-chiro-inositol? J Ovarian Res. 2012; 5(1): 14.
- Garzon S., Lagana A.S., Monastra G. Risk of reduced intestinal absorp- tion of myo-inositol caused by D-chiro-inositol or by glucose transporter inhibitors. Expert Opin Drug Metab Toxicol. 2019; 15(9): 697-703.
- Genazzani A.D., Lanzoni C., Ricchieri F., Jasonni V.M. Myo-inositol administration positively affects hyperinsulinemia and hormonal parameters in overweight patients with polycystic ovary syndrome. Gynecol Endocrinol. 2008; 24(3): 139-44.
- Cheang K.I., Baillargeon J.-P., Essah P.A., Ostlund Jr R.E., Apridonize T. et al. Insulin-stimulated release of D-chiro-inositol-containing inositolphosphoglycan mediator correlates with insulin sensitivity in women with polycystic ovary syndrome. Metabolism. 2008; 57(10): 1390-7.
- Genazzani A.D., Santagni S., Rattighieri E., Chierchia E., Despini G. et al. Modulatory role of D-chiro-inositol (DCI) on LH and insulin secretion in obese PCOS patients. Gynecol Endocrinol. 2014; 30(6): 438-43.
- La Marca A., Grisendi V., Dondi G., Sighinolfi G., Ciaci A. The menstrual cycle regularization following D-chiro-inositol treatment in PCOS women: a retrospective study. Gynecol Endocrinol. 2015; 31(1): 52-6.
- Lagana A.S., Unfer V. D-chiro-inositol’s action as aromatase inhibitor: rationale and potential clinical targets. Eur Rev Med Pharmacol Sci. 2019; 23(24): 10575-6.
- Ravanos K., Monastra G., Pavlidou T., Goudakou M., Prapas N. Can high levels of D-chiro- inositol in follicular fluid exert detrimental effects on blastocyst quality? Eur Rev Med Pharmacol Sci. 2017; 21(23): 5491-8.
- Bevilacqua A., Dragotto J., Giuliani A., Bizzarri M. Myo-inositol and D-chiroinositol (40:1) reverse histological and functional features of polycystic ovary syndrome in a mouse model. J Cell Physiol. 2019; 234(6): 9387-8.
- Nordio M., Basciani S., Camajani E. The 40:1 myo-inositol/D-chiro- inositol plasma ratio is able to restore ovulation in PCOS patients: comparison with other ratios. Eur Rev Med Pharmacol Sci. 2019; 23(12): 5512-21.
- Benelli E., Del Ghianda S., Di Cosmo C., Tonacchera M. A combined therapy with myo-inositol and D-chiro-inositol improves endocrine para- meters and insulin resistance in PCOS young overweight women. Int J Endocrinol. 2016; 2016: 3204083.
- Le Donne M., Metro D., Alibrandi A., Papa M., Benvenga S. Effects of three treatment modalities (diet, myoinositol or myoinositol associated with D-chiroinositol) on clinical and body composition outcomes in women with polycystic ovary syndrome. Eur Rev Med Pharmacol Sci. 2019; 23(5): 2293-2301.
- Colazingari S.T.M., Najjar R., Bevilacqua A. Treatment of hyperandrogenism by Myo-inositol: results from a randomized controlled trial. Arch Gynecol Obstet. 2013; 11: 1405.
- Shen Q.W., Zhu M.J., Tong J., Ren J., Du M. Ca2+/calmodulin-dependent protein kinase kinase is involved in AMP-activated protein kinase activation by alpha-lipoic acid in C2C12 myotubes. Am J Physiol Cell Physiol. 2007; 293(4): C1395-403.
- Morikawa T., Yasuno R., Wada H. Do mammalian cells synthesize lipoic acid? Identification of a mouse cDNA encoding a lipoic acid synthase located in mitochondria. FEBS Lett. 2001; 498(1): 16-21.
- Gomes M.B., Negrato C.A. Alpha-lipoic acid as a pleiotropic com- pound with potential therapeutic use in diabetes and other chronic diseases. Diabetol Metab Syndr. 2014; 6(1): 80.
- Scaramuzza A., Giani E., Radaelli F., Ungheri S., Macedoni M. et al. Alpha-Lipoic Acid and Antioxidant Diet Help to Improve Endothelial Dysfunction in Adolescents with Type 1 Diabetes: A Pilot Trial. J Diabetes Res. 2015; 2015:474561.
- Genazzani A.D., Shefer K., Della Casa D., Prati A., Napolitano A. et al. Modulatory effects of alpha-lipoic acid (ALA) administration on insulin sensitivity in obese PCOS patients. J Endocrinol Invest. 2018; 41(5): 583-90.
- Xie G.-b., Xu P., Che Y.-n., Xia Y.-j., Cao Y.-x. et al. Microsatellite polymorphism in the fibrillin 3 gene and susceptibility to PCOS: a case-control study and meta-analysis. Reprod Biomed Online. 2013; 26(2): 168-74.
- Genazzani A.D., Prati A., Simoncini T., Napolitano A. Modulatory role of D-chiro-inositol and alpha lipoic acid combination on hormonal and metabolic parameters of overweight/obese PCOS patients. Eur Gynecol Obstetr. 2019; 1(1): 29-33.
- Cianci A., Panella M., Fichera M., Falduzzi C., Bartolo M., Caruso S. d-chiro-Inositol and alpha lipoic acid treatment of metabolic and menses disorders in women with PCOS. Gynecol Endocrinol. 2015; 31(6): 483-6.
- De Cicco S., Immediata V., Romualdi D., Policola C., Tropea A. et al. Myoinositol combined with alpha-lipoic acid may improve the clinical and endocrine features of polycystic ovary syndrome through an insulin-independent action. Gynecol Endocrinol. 2017; 33(9): 698-701.
- Genazzani A.D., Despini G., Santagni S. et al. Effects of a combination of alpha lipoic acid and myo-inositol on insulin dynamics in over- weight/ obese patients with PCOS. Endocrinol Metab Synd. 2014;3:3.
Источник изображений на данной странице – Shutterstock / Fotodom.
