Хаджиева Н.Х.1, Вознесенская Т.Г.2, Бурчакова М.Н.3

1ЧУЗ «Центральная клиническая больница “РЖД-Медицина”», Москва, Российская Федерация.
2ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова Минздрава России», Москва, Российская Федерация.
3Московский государственный гуманитарный университет, Москва, Российская Федерация.
Резюме
Цель исследования: определить стрессовые факторы, способные повлиять на менструальный цикл, и оценить возможности средств, повышающих резерв адаптации, в коррекции стресс-зависимых расстройств менструального цикла. Пациенты и методы исследования: проведено комплексное двухэтапное исследование при участии 82 женщин с нарушениями менструального цикла, последовавшими за стрессовым воздействием, и 20 здоровых женщин с регулярными менструациями. Применялись клинико-анамнестическое обследование, исследование гормонального статуса, инструментальное обследование (УЗИ), анкетирование по оригинальному опроснику, экспериментально-психологическое тестирование с использованием шкалы депрессии Бэка, шкалы изменения реактивной и личностной тревожности Спилбергера – Ханина, шкалы жизненных событий Холмса – Рея, шкалы оценки ночного сна, опросника вегетативных расстройств и шкалы оценки качества жизни. В последующем наблюдательном исследовании была выполнена оценка эффективности индивидуально подобранной терапии, направленной на повышение адаптационных свойств организма. Результаты: основным фактором, воздействующим на менструальный цикл у подавляющего большинства пациенток, был психологический стресс (97 %). В 59,7 % случаев пациенты отметили влияние сразу нескольких факторов (психологический стресс и физические нагрузки, психологический стресс и смена часовых поясов). По сравнению с контрольной группой женщины с нарушениями менструального цикла демонстрировали достоверно более высокие средние уровни депрессивности, тревожности и вегетативной дисфункции. Качество сна у исследуемой группы было достоверно ниже, а потеря качества жизни существенно выше, чем у женщин с регулярным менструальным циклом. Негормональная коррекция была эффективна у 17 (20,7 %) женщин. Заключение: наибольшее влияние на менструальный цикл оказывает психологический стресс. В большинстве случаев стрессовая нагрузка представлена сочетанием нескольких факторов. Негормональная коррекция эффективна у женщин с регулярными менструациями в анамнезе, длительностью нарушения не более 3 месяцев, гормональными показателями крови в пределах референсных значений и отсутствием депрессивных и тревожных расстройств.
Ключевые слова: менструальный цикл, стресс, стрессовые факторы, адаптация, нарушения менструального цикла, аменорея, олигоменорея.
Одной из черт развитого техногенного общества является постоянное воздействие факторов внешней среды на физическое и психическое здоровье [1]. Текущая ситуация в мире обусловливает высокую вероятность развития стресс-зависимых нарушений здоровья с далеко идущими негативными последствиями [2]. Женщины в большей степени по сравнению с мужчинами подвержены стресс-зависимым расстройствам, их нейроэндокринная репродуктивная ось реагирует на стрессоры возникновением целого ряда адаптационных реакций, которые могут трансформироваться в болезнь или подвергнуться обратному развитию [3–9]. Теоретически все факторы, влияющие на нейрогуморальные процессы в центральной нервной системе (ЦНС), могут привести к функциональным нарушениям менструального цикла.
Более глубокое понимание механизма воздействия различных факторов внешней среды на развитие нарушений менструального цикла помогает определить возможную причину этой дисфункции и сориентировать специалистов по разработке профилактических мер, позволяющих снизить уровень распространенности заболеваний и сократить расходы системы здравоохранения.
Цель исследования
Определить стрессовые факторы, способные повлиять на менструальный цикл, и оценить возможности средств, повышающих резерв адаптации, в коррекции стресс-зависимых расстройств менструального цикла.
Пациенты и методы исследования
В исследование были включены 82 участницы, соответствовавшие следующим критериям: возраст 18– 39 лет; жалобы на расстройства менструального цикла; указание на стрессовое событие как на предполагаемую причину нарушения менструального цикла; индекс массы тела (ИМТ) в пределах от 18 до 24,9 кг/м2; регулярный менструальный цикл без каких-либо жалоб не менее полугода до отмеченных нарушений.
Критерии невключения/исключения: органические заболевания репродуктивной системы (миома матки, аденомиоз, патология эндометрия и др.) как причина нарушений менструального цикла; эндокринопатии (заболевания щитовидной железы, синдром поликистозных яичников, аденома гипофиза, врожденная дисфункция коры надпочечников и др.); применение лекарственных средств или пищевых добавок, способных повлиять на характеристики менструального цикла или имеющих психотропное действие. В группу контроля вошли 20 здоровых женщин в возрасте 18– 39 лет с регулярным менструальным циклом.
В ходе исследования проведены: изучение общего и гинекологического анамнеза, физикальный и гинекологический осмотр, исследование гормонального профиля, инструментальное обследование (УЗИ).
Всем пациенткам на этапе скрининга была предложена самостоятельная оценка факторов, в настоящее время или в прошлом повлиявших на регулярность или другие характеристики менструального цикла. Принимая во внимание эти данные, мы разработали опросник, в котором рассмотрели потенциальные внешние факторы, способные оказать воздействие на менструальный цикл. Стрессовые факторы, указанные женщинами в качестве возможных причин нарушений менструального цикла, были сгруппированы в три кластера: психологические, метаболические и физические стрессоры. Далее был проведен анализ изменений характера менструального цикла в результате действия предполагаемых стрессовых факторов с учетом следующих характеристик: продолжительность менструального цикла, длительность и обильность менструального кровотечения, появление межменструальных кровотечений, самочувствие перед менструациями и во время менструаций, включая болевые ощущения.
Для оценки распространенности и силы действия стрессовых факторов была использована математическая модель расчета. Каждый вопрос содержал 8 пунктов, отражающих конкретное изменение менструальной функции; при обработке данных каждый положительный ответ получал один балл. Средний балл в группе обследуемых представлял сумму баллов, набранных по каждому стрессору. Показатель «сила балла» был получен в результате сложения количества баллов, набранных по каждому фактору, с учетом их распространенности.
Все пациентки прошли экспериментально-психологическое обследование. Уровень стрессогенности оценивался по шкале жизненных событий Холмса – Рея. Уровень качества жизни определялся по опроснику, состоящему из 8 аналоговых шкал, оценивающих параметры: физическая активность, удовлетворенность жизненной ситуацией, контроль над эмоциями, представления о будущем, настроение, отношения с супругом, социальные контакты. Оценка вегетативных расстройств выполнялась по опроснику А. М. Вейна. Общая сумма баллов, превышающая 15, расценивалась как признак вегетососудистой дистонии (ВСД); заключение «ВСД» эквивалентно диагнозу «соматоформная дисфункция вегетативной нервной системы» согласно МКБ-10 (F45.3).
Анкета нарушений сна состояла из шести пунктов, по которым оценивались время засыпания, продолжительность сна, ночные пробуждения, сновидения, качество сна, качество пробуждения. Для оценки степени выраженности депрессии использовали шкалу депрессии Бека, уровень тревожности оценивался по шкале Спилбергера – Ханина.
После проведенного обследования всем пациенткам была рекомендована негормональная коррекция, направленная на восстановление адаптационных резервов организма. В качестве негормональной терапии мы использовали терапевтическую модификацию образа жизни, ноотропные лекарственные средства (пирацетам 400 мг 2 раза в сутки – 1 месяц), экстракт витекса священного (40 мг в сутки – до 6 месяцев, в случае планирования беременности в ближайшие полгода – в составе витаминно-минерального комплекса Прегнотон), оральные препараты органических солей магния (лактат магния/пиридоксин гидрохлорид 300 мг в сутки в перерасчете на магний – 1 месяц), 5-гидрокситриптофан (100 мг 2 раза в суки – 2 месяца), мелатонин (3 мг за 30–40 минут до сна – до 3 месяцев), биологически активную добавку (БАД) с инозитолом Дифертон® (мио-инозитол (МИ) 1100 мг, D-хироинозитол (ДХИ) 27,6 мг, альфа-липоевая кислота 75 мг, фолиевая кислота 600 мкг, витамин D 10 мкг, марганец 5 мг), транексамовую кислоту в максимальной суточной дозе 3 г. В 9 наблюдениях применялись психотропные средства, назначение и подбор которых осуществлялись неврологом. Индивидуальный выбор средств негормональной регуляции базировался на описанных в литературе способах коррекции функциональных расстройств менструального цикла [10–18].
В ходе негормональной коррекции эффект отслеживали каждые 3 месяца. Если за указанный период отмечалось восстановление менструального цикла или улучшение его характеристик по сравнению с предшествующими тремя месяцами, лечение продолжали, оценивая характеристики менструального цикла каждые 3 месяца вплоть до завершения периода наблюдения за пациенткой. При возобновлении нарушений менструального цикла или неэффективности негормональной коррекции назначали гормональную терапию. Общий период наблюдения и ведения каждой пациентки составил 12 месяцев.
Статистический анализ полученных данных проводился с использованием пакетов статистических программ Microsoft Excel 2003, BIOSTAT version 4.03, SPSS version 15.0 (США). Для проверки на нормальность распределения наблюдаемых признаков применялись критерии Колмогорова – Смирнова. Парный t-критерий Стьюдента, дисперсионный анализ и критерий Ньюмана – Кейлса вычислялись для нормально распределенных переменных, критерии Манна – Уитни, Крускала – Уоллиса, χ2 – в случаях, когда закон распределения исследуемых величин отличался от нормального. Корреляционный анализ выполнялся с помощью метода Пирсона для нормально распределенных признаков, метода Спирмена – для остальных. В ходе анализа использовались три уровня значимости различий: р < 0,05; p < 0,01; p < 0,001 – достоверность различий 95, 99 и 99,9 %.
Результаты исследования
В соответствии с критериями включения в исследовании приняли участие 82 женщины в возрасте от 18 до 39 лет, средний возраст 25,9 ± 5,78 лет. Средний возраст пациенток контрольной группы составил 26,2 ± 5,65 лет (р > 0,05).
В структуре стресс-зависимых нарушений менструального цикла доминировала олигоменорея – 65 (79,3 %) наблюдений, на долю аменореи пришлось 12 (14,6 %) наблюдений. Длительность задержки менструации варьировала от 20 дней до 1,5 лет и составила в среднем 3 месяца. Нарушения менструального цикла по типу аномального маточного кровотечения и предменструальный синдром встречались в 3 (3,7 %) и 2 (2,4 %) наблюдений соответственно.
Анализ полученных в результате анкетирования данных позволил выявить стрессовые факторы, спровоцировавшие нарушения менструального цикла, определить их распространенность, мощность воздействия и значимость (табл. 1, 2). Самыми рас-пространенными причинами, приводящими к расстройствам менструального цикла, оказались эмоциональные переживания, связанные с различными событиями недавнего прошлого, длительные и избыточные физические нагрузки, изменение часовых поясов (перелеты, переезды на большие расстояния), нарушения режима (сменная работа, бессонные ночи), умственное переутомление.
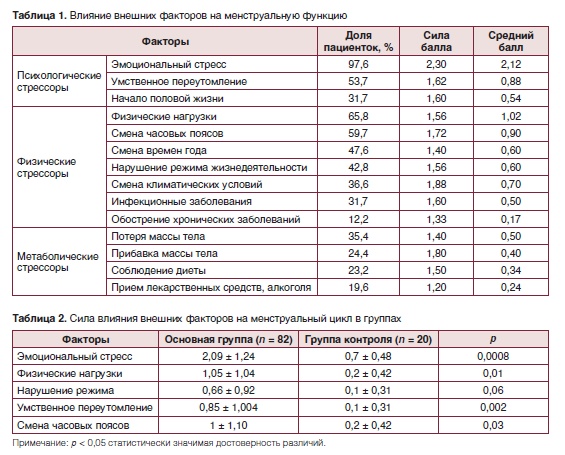
Более чем половина пациенток – 49 (59,7 %) наблюдений – отметили влияние сразу нескольких факторов на нарушение менструального цикла. Наиболее часто сочетающимися факторами были: эмоциональный стресс и физические нагрузки у 35 (42,7 %) женщин, эмоциональный стресс и смена часовых поясов у 30 (36,6 %) пациенток.
В группе контроля влияние стресса на менструальный цикл в прошлом отметили 7 (35 %) женщин. Как и в основной группе, мы наблюдали сочетанное влияние нескольких стрессоров. Факторы «интенсивная физическая нагрузка» и «смена времен года» были выявлены у двух женщин. Нарушение режима одновременно с умственным переутомлением оказывало влияние на менструальную функцию у одной женщины. У всех 7 женщин, вне зависимости от характеристик стрессового фактора, в ответ на него отмечалась задержка менструации максимальной длительностью до 1 месяца.
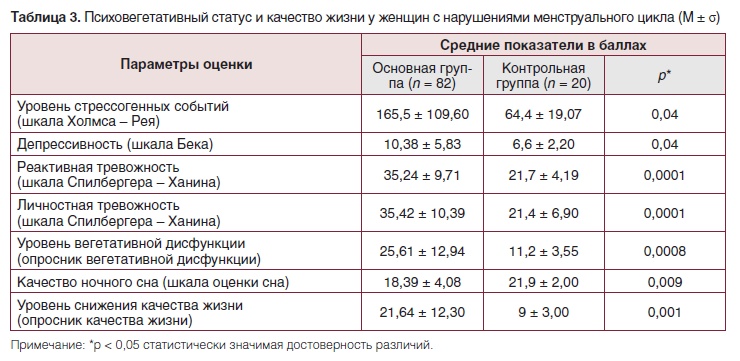
Средний уровень стрессовых событий был существенно выше в группе исследования, что соответствовало критериям включения (табл. 3). По сравнению с контрольной группой женщины с нарушениями менструального цикла демонстрировали достоверно более высокие средние уровни депрессивности, тревожности и вегетативной дисфункции. Качество сна у исследуемой группы было достоверно ниже, а потеря качества жизни существенно выше, чем у женщин с регулярным менструальным циклом.
Все пациентки получали Дифертон® в течение трех месяцев. Ноотропные лекарственные средства (пирацетам 400 мг 2 раза в сутки) были также рекомендованы всем пациенткам курсом длительностью один месяц. Психотропная терапия (флувоксамин, флуоксетин) была назначена неврологом 9 женщинам с высоким уровнем тревожно-депрессивных расстройств. Экстракт витекса священного использовали у пациенток с уровнем пролактина, превышающим 350 нмоль/л. Данный порог отсечки был выбран в связи с тем, что эта концентрация пролактина соответствовала в нашем исследовании уровню стрессогенности 150 баллов и более по шкале Холмса – Рея, а число баллов, превышающее этот порог, оказывает, очевидно, негативное влияние на здоровье [19]. Мелатонин назначался пациенткам с указанием в анамнезе на частую смену часовых поясов, депривацией сна, нарушением режима сон – бодрствование. Предшественник серотонина – 5-гидрокситриптофан – рекомендовали пациенткам с легкой степенью депрессии, низким и средним уровнями тревоги, а также нарушением сна. Препараты органических солей магния для орального применения использовали у женщин с проявлениями вегетативной дисфункции, легкой степенью выраженности психосоматических проявлений стресса. Женщинам с аномальными маточными кровотечениями для контроля кровопотери назначали транексамовую кислоту в максимальной суточной дозе 3 г.
Через три месяца от начала терапии мы оценили ее результаты в отношении характеристик менструального цикла. У 11/65 (16,9 %) пациенток с олигоменореей удалось достичь восстановления ритма менструаций на период не менее 1 года. У одной женщины с обильным менструальным кровотечением был достигнут негормональный гемостаз, продолжительность последующих менструаций была до 6 дней с нормальным по обильности кровотечением.
У 5/65 (6,1 %) пациенток с нормогонадотропной олигоменореей в течение первого трехмесячного периода отслеживания эффекта негормональной терапии наблюдалась положительная динамика, которая выражалась в появлении спонтанных менструаций и укорочении межменструальных интервалов с 45,34 ± 6,32 до 40,43 ± 5,21 дней. Однако следую-щий трехмесячный период не сопровождался дальнейшим улучшением ритма менструаций, что послужило основанием для назначения гормональной терапии. У женщин с ПМС, аменореей эффекта от негормональной терапии не было.
Таким образом, терапия была эффективна у 17 (20,7 %) пациенток. В анамнезе у этих пациенток был регулярный менструальный цикл, гормональные показатели крови не выходили за рамки референсных значений. Оценка уровня психосоциального стресса показала низкую стрессодоступность у этих пациенток (по шкале Холмса – Рея менее 150 баллов), также были выявлены низкие уровни реактивной и личностной тревоги (по шкале Спилбергера – Ханина менее 30 баллов), отсутствие депрессивных симптомов (по шкале Бэка не более 9 баллов) и нормальное вегетативное обеспечение (по опроснику вегетативной дисфункции не более 15 баллов).
Негормональные интервенции улучшали общее самочувствие, снижали, по субъективным ощущениям и объективной оценке врача-невролога, уровень тревоги и депрессии, улучшали вегетативное обеспечение, качество сна и качество жизни в целом, но не играли самостоятельной роли в нормализации менструального цикла у 85,4 % женщин.
Обсуждение результатов исследования
Факторы внешней среды, постоянно влияющие на организм человека, стремятся изменить его состояние, но при этом включаются механизмы, предотвращающие или компенсирующие возникшие изменения. Разработка вопросов, связанных с оценкой функци-ональных состояний здорового организма, была начата несколько десятилетий назад в рамках проблемы прогнозирования состояния здоровья космонавтов. Именно в области космической медицины была разработана концепция возможности использования системы кровообращения в качестве индикатора адаптационных реакций целостного организма. Сердечно-сосудистая система первой реагирует на изменения условий внешней среды, будучи важнейшим регулятором жизнедеятельности организма и поддержания его гомеостаза посредством адекватного кровоснабжения органов. Математическая формула расчета адаптационного потенциала системы кровообращения позволяет косвенно судить о способности к адаптации всего организма [20].
Менструальный ритм также считается одним из важнейших маркеров благополучия организма в целом [21] наряду с ритмом сердечных сокращений, дыхательных движений и др. По аналогии с вариабельностью сердечного ритма у здорового человека, переживающего стрессовую нагрузку, расстройства менструального цикла у женщины могут отражать не наличие заболевания, а адаптационные риски, обусловленные приспособлением организма к условиям среды [20].
Отличие этого витального признака женского организма от других жизненно важных биоритмов состоит в том, что его приспособительные изменения не несут в себе адаптационного потенциала. Механизм жизнеобеспечения работает на выключение овуляции или менструации с целью извлечения из репродуктивной системы ресурса на поддержание гомеостаза. Вместе с тем, преодолевая стрессовую нагрузку, нейроэндокринные процессы в гипоталамусе тормозят фертильность. Таким образом, биологический смысл стресс-зависимых нарушений менструального цикла очевиден: выключение циклического функционирования репродуктивной системы, во-первых, позволяет пополнить адаптационный резерв, во-вторых, не допускает наступления беременности в условиях, неблагоприятных как для самого организма, так и для рождения здорового потомства.
Разумеется, для запуска описанного механизма необходимы или мощное стрессовое воздействие, или повышенная стрессовая чувствительность нейроэндокринной системы. Первый вариант развития событий демонстрируют такие клинические формы аменореи, как: аменорея военного времени (психологический стресс), аменорея спортсменок (физический стресс), аменорея на фоне потери массы тела (метаболический стресс) [22]. Второй вариант связан с умеренной стрессовой нагрузкой и свидетельствует о врожденной или приобретенной избыточной реактивности нейроэндокринной репродуктивной оси на внешние стимулы [23].
Вне зависимости от силы стрессового воздействия или степени чувствительности нейроэндокринной репродуктивной оси к стрессу нарушения менструального цикла сигнализируют о недостаточности адаптационного резерва, перераспределяемого на нужды гомеостаза, и эти нарушения нельзя игнорировать. Наше пилотное исследование демонстрирует потенциальную возможность создания модели оценки адаптационного резерва репродуктивной системы, но его выборка и мощность недостаточно велики для решения подобной задачи.
Исходя из понимания управляемости менструальным циклом как рычага извлечения необходимых для гомеостаза ресурсов, можно сделать вывод, что восстановления ритма менструаций следует ожидать только при возвращении растраченного резерва адаптации. Клинические исследования и их систематизированные обзоры подтверждают правомочность данной концепции. Дотация микронутриентов, влияющих на адаптационный потенциал, снижает концентрацию кортизола в слюне, уменьшает уровень тревоги и увеличивает стрессоустойчивость у женщин с менструально-ассоциированными нарушениями [24].
Целесообразность включения в схему нутриентного сопровождения всех пациенток комплекса Дифертон® была продиктована свойствами входящих в его состав витаминов и минерала. Инозитолы – МИ и ДХИ, составляющие основу комплекса, оказывают значимое воздействие не только на углеводный обмен (увеличивают чувствительность тканей к инсулину), но также и на половые железы [25, 26]. В яичниках МИ выполняет функции вторичного мессенджера фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ). Сигнальные пути ФСГ и ЛГ влияют на пролиферацию клеток теки и гранулезы. Гонадотропины стимулируют цАМФ-зависимую протеинкиназу А, это сопровождается пролиферацией клеток гранулезы и стероидогенезом через индукцию экспрессии ароматазы [26]. В ряде исследований продемонстрировано, что пропорция МИ/ДХИ 40 : 1, входящая в состав комплекса Дифертон®, идентичная физиологическому соотношению концентраций инозитолов в плазме крови, оптимальна для ведения женщин с ановуляторной дисфункцией яичников [27]. Марганец, МИ и ДХИ, повышая чувствительность яичников к гонадотропинам, создают условия для восстановления овуляторных менструальных циклов [28].
В то же время компоненты комплекса Дифертон® нацелены и на функциональные механизмы реализации стресс-зависимых расстройств. Это положение можно отнести на счет инозитолов, марганца, витамина D и фолиевой кислоты. Метаанализ 2017 года, включивший 43 контролируемых исследования, показал, что у людей с депрессией концентрация фолатов в плазме крови ниже, чем у людей с нормальным психическим статусом [29]. Роль фолиевой кислоты не ограничена положительным эффектом в отношении ЦНС, фолаты обеспечивают нормальное функционирование менструального цикла, опосредованно влияя на синтез гонадотропинов и стероидов, модулируя уровни эстрогенов и ранний фолликулогенез [30]. Точно так же на продукцию яичниковых гормонов, поддержку фолликулогенеза и лютеогенеза воздействует витамин D. В клетках гранулезы кальцитриол через рецепторы витамина D регулирует передачу сигналов антимюллерова гормона, влияя на чувствительность клеток к ФСГ и синтез прогестерона [31].
Окислительный стресс на уровне яичников может привести к нарушению процессов фолликулогенеза, овуляции и лютеогенеза. Противодействие окислительному стрессу осуществляют антиоксидантные ферменты, нейтрализующие активные формы кислорода (АФК) и оказывающие овариальную протекцию. От агрессии свободных радикалов организм защищают каталаза, супероксид дисмутаза (СОД), глутатион пероксидаза (ГТП) и другие ферменты, а также неэнзимные антиоксиданты: витамин Е, витамин С, глутатион, мочевая кислота, альбумин [32]. В фолликулах яичника идентифицируются СОД, ГТП и все неэнзимные антиоксиданты [31]. Уровень СОД в фолликулярной жидкости обратно пропорционален частоте повреждения ДНК, вызванного окислительным стрессом в ооцитах. Выступая в роли антиоксиданта, альфа-липоевая кислота, входящая в состав комплекса Дифертон®, захватывает и нейтрализует АФК (пероксильный, гидроксильный и супероксид- радикалы), а также служит донором электронов для восстановления других антиоксидантов, в том числе глутатиона. Увеличение уровней вне- и внутриклеточного глутатиона под влиянием липоевой кислоты было доказано экспериментальным путем на клеточных культурах крови человека [32]. Таким образом, многоцелевое действие комплекса Дифертон® обосновывает его включение в схемы терапии нарушений менструального цикла, связанных со стрессовым воздействием. Более того, при недостаточном эффекте негормональных интервенций Дифертон® может сопровождать гормональную терапию, устраняя ее возможные побочные реакции и улучшая исходы лечения.
В целом стратегия повышения функционального резерва женского организма, переживающего стресс и манифестирующего о недостатке ресурсов адаптации нарушением менструального цикла, должна включать индивидуально подобранную лекарственную терапию и дотацию биологически активных веществ, способных восполнить возникший дефицит ресурсов.
Заключение
Наиболее распространенным фактором, влияющим на менструальную функцию, является психологический стресс, в большинстве случаев действующий в совокупности с другими стрессорами (интенсивные физические нагрузки, смена часовых поясов). Реакция репродуктивной нейроэндокринной оси на стресс чаще всего связана с олиго/аменореей. Характер ответа на внешнее воздействие не специфичен, т. е. не зависит от особенностей действующего стрессора. Негормональные интервенции улучшают процесс адаптации организма к стрессовой ситуации, тем самым обеспечивая возможность спонтанного восстановления менструального цикла у женщин с недавно возникшими нарушениями менструального цикла в ответ на стрессовую нагрузку.
Литература
- Всемирная организация здравоохранения. Профилактика болезней путем создания здоровых окружающих условий. Оценка экологического компонента бремени болезней. Женева, 2016.
- World Health Organization. Mental health and psychosocial considerations during the COVID-19 outbreak. Geneva: WHO; 2020.
- Sharma R, Biedenharn KR, Fedor JM, Agarwal A. Lifestyle factors and reproductive health: taking control of your fertility. Reprod Biol Endocrinol. 2013; 11: 66–81. doi: 10.1186/1477-7827-11-66
- Valsamakis G, Chrousos G, Mastorakos G. Stress, female reproduction and pregnancy. Psychoneuroendocrinology. 2019; 100: 48–57. doi: 10.1016/j.psyneuen.2018.09.031
- Lucassen PJ, Pruessner J, Sousa N, et al. Neuropathology of stress. Acta Neuropathol. 2014; 127: 109– 135. doi: 10.1007/s00401-013-1223-5
- Toufexis D, Rivarola MA, Lara H, Viau V. Stress and the Reproductive Axis. J Neuroendocrinol. 2014; 26(9): 573–586. doi: 10.1111/jne.12179
- Walton JC, Weil ZM, Nelson RJ. Influence of photoperiod on hormones, behavior, and immune function. Front Neuroendocrinol. 2011; 32(3): 303–319. doi: 10.1016/j.yfrne.2010.12.003
- Всемирная организация здравоохранения. Европейское руководство по контролю ночного шума. Женева, 2014.
- WHO. Environmental Noise Guidelines for the European Region. 2018: Copenhagen.
- Milewska EM, Czyzyk A, Meczekalski B, Genazzani AD. Inositol and human reproduction. From cellular metabolism to clinical use. Gynecol Endocrinol. 2016; 32(9): 690–695. doi: 10.1080/09513590.2016. 1188282
- Gordon CM, Ackerman KE, Berga SL, et al. Functional Hypothalamic Amenorrhea: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2017; 102(5): 1413–1439. doi: 10.1210/jc.2017- 00131
- Shufelt CL, Torbati T, Dutra E. Hypothalamic Amenorrhea and the Long-Term Health Consequences. Semin Reprod Med. 2017; 35(3): 256–262. doi: 10.1055/s-0037-1603581
- Вейн А.М., Вознесенская Т.Г. Депрессия в неврологической практике. М.: Медицинское информационное агентство, 2007. С. 152–154.
- Всемирная организация здравоохранения. Оценка и лечение состояний, связанных исключительно со стрессом. Раздел «Руководства mhGAP по принятию мер в отношении психических и неврологических расстройств». – Женева, 2015.
- Коденцова В.М., Вржесинская О.А. Витамины и окислительный стресс // Вопросы питания. 2013; 3: 11–18.
- Caumo W, Hidalgo MP, Souza A, et al. Melatonin is a biomarker of circadian dysregulation and is correlated with major depression and fibromyalgia symptom severity. J Pain Res. 2019; 12: 545–556. doi: 10.2147/JPR.S176857
- Genazzani AD, Despini G, Czyzyk A, et al. Modulatory effects of l-carnitine plus l-acetyl-carnitine on neuroendocrine control of hypothalamic functions in functional hypothalamic amenorrhea (FHA). Gynecol Endocrinol. 2017; 33(12): 963–967. doi: 10.1080/09513590.2017.1332587
- Bradley LD, Gueye NA. The medical management of abnormal uterine bleeding in reproductive-aged women. Am J Obstet Gynecol. 2016; 214(1): 31–44. doi: 10.1016/j.ajog.2015.07.044
- Holmes TH, Rahe RH. The Social Readjustment Rating Scale. J Psychosom Res. 1967; 11(2): 213–218. doi: 10.1016/0022-3999(67)90010-4
- Бабаевский Р.М., Фунтова И.И., Лучицкая Е.С. Некоторые особенности адаптации сердечно-сосудистой системы к длительному и безопасному пребыванию в невесомости. Проблема физиологической нормы: математическая модель функциональных состояний на основе анализа вариабельности сердечного ритма // Пилотируемые полеты в космос. 2019; 3 (32): 68–77. doi: 10.34131/MSF.19.3.68-77
- Committee Opinion No. 651 Summary: Menstruation in Girls and Adolescents: Using the Menstrual Cycle as a Vital Sign. Obstet Gynecol. 2015; 126(6): 1328. doi: 10.1097/AOG.0000000000001210
- Morrison AE, Fleming S, Levy MJ. A review of the pathophysiology of functional hypothalamic amenorrhoea in women subject to psychological stress, disordered eating, excessive exercise or a combination of these factors. Clin Endocrinol (Oxf). 2021; 95(2): 229–238. doi: 10.1111/cen.14399
- Caronia LM, Martin C, Welt CK, et al. A genetic basis for functional hypothalamic amenorrhea. N Engl J Med. 2011; 364(3): 215–225. doi: 10.1056/NEJMoa0911064
- McCabe D, Lisy K, Lockwood C, Colbeck M. The impact of essential fatty acid, B vitamins, vitamin C, magnesium and zinc supplementation on stress levels in women: a systematic review. JBI Database System Rev Implement Rep. 2017; 15(2): 402–453. doi: 10.11124/JBISRIR-2016-002965
- Bevilacqua A, Bizzarri M. Inositols in Insulin Signaling and Glucose Metabolism. Int J Endocrinol. 2018; 25: 1968450. doi: 10.1155/2018/1968450
- Пустотина О.А., Дикке Г.Б., Остроменский В.В. Роль инозитола в репродукции человека // Акушерство и гинекология. 2022; 2: 111–118. doi: 10.18565/aig.2022.2.111-118/
- Nordio M, Basciani S, Camajani E. The 40:1 myo-inositol/D-chiro-inositol plasma ratio is able to restore ovulation in PCOS patients: comparison with other ratios. Eur Rev Med Pharmacol Sci. 2019; 23 (12): 5512–5521. doi: 10.26355/eurrev_201906_18223
- Громова О.А., Андреева Е.Н., Торшин И.Ю. и др. Системно-биологический анализ ролей марганца в акушерстве и гинекологии: репродуктивное здоровье женщины, регуляция менструального цикла и профилактика пороков развития плода // Вопросы гинекологии, акушерства и перинатологии. 2020; 19(1): 103–113. doi: 10.20953/1726- 1678-2020-1-103-113
- Bender A, Hagan KE, Kingston N. The association of folate and depression: A meta-analysis. J Psychiatr Res. 2017; 95: 9–18. doi: 10.1016/j.jpsychires.2017.07.019
- Twigt JM, Hammiche F, Sinclair KD. Preconception folic acid use modulates estradiol and follicular responses to ovarian stimulation. J Clin Endocrinol Metab. 2011; 96(2): E322–E329. doi: 10.1210/jc.2010-1282
- Arslan S, Akdevelioрlu Y. The relationship between female reproductive functions and vitamin D. J Am Coll Nutr. 2018; 13: 1–6. doi: 10.1080/07315724.2018. 1431160
- Richard PU, Duskey JT, Stolarov S, et al. New concepts to fight oxidative stress: nanosized three-dimensional supramolecular antioxidant assemblies. Expert Opin. Drug Deliv. 2015; 12(9): 1527–1545. doi: 10.1517/17425247.2015.1036738
- Пигарова Е.А., Петрушкина А.А., Морозова Е.В. Терапевтические возможности альфа-липоевой кислоты // Эффективная фармакотерапия. 2019; 15 (12): 40–45. doi: 10.33978/2307-3586-2019-15-12-40-45
Источник изображений на данной странице – Shutterstock / Fotodom.
