Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А.

Кафедра урологии (зав. — д-р мед. наук, доц. Кузьменко А. В.) ФГБОУ ВО «Воронежский государственный медицинский университет им. Н. Н. Бурденко»
Введение. В настоящее время одним из принципов терапии инфертильности у мужчин служат коррекция окислительного стресса, восполнение витаминов, микроэлементов и низкомолекулярных пептидов, в связи с чем широкое применение нашли многокомпонентные биологически активные комплексы, одним из которых является Сперотон.
Цель исследования: оценка влияния комплекса Сперотон на функциональные характеристики сперматозоидов и фертильность мужчин с патозооспермией.
Материалы и методы. Нами были обследованы 60 мужчин с диагностированным мужским бесплодием на фоне различных нарушений сперматогенеза. Возраст от 25 до 40 лет. Пациенты были рандомизированы на 2 группы по 30 человек. В контрольной группе (КГ) проведена общая терапия. В основной группе (ОГ) в сочетании с общей терапией пациенты получали Сперотон. Обследование мужчин проведено в ходе четырех визитов. Оценивались показатели спермограммы в соответствии с критериями ВОЗ: концентрация, подвижность, количество сперматозоидов с нормальной морфологией, объем и время разжижения эякулята, уровень фруктозы и цинка, а также случаи наступления беременности у партнерши.
Результаты. Применение комплекса Сперотон позволило увеличить объем эякулята на 10%, концентрацию сперматозоидов – на 15,6%, уменьшить время разжижения на 32%. Доля сперматозоидов с поступательным движением (категории А+В) увеличилась в 2,6 раза за счет активизации сперматозоидов категории C. Это, на наш взгляд, может быть связано с изменением ферментного состава эякулята, что косвенно подтверждается повышением уровня фруктозы в 1,6 раза, а также увеличением количества цинка на 15% в биохимическом анализе спермы.
Эффективность терапии, проведенной в ОГ пациентов, также подтверждается четырьмя случаями спонтанной беременности, которая наступила на фоне качественных изменений показателей спермы.
Заключение. Таким образом, применение Сперотона позволяет повышать подвижность и концентрацию сперматозоидов у пациентов с мужским фактором бесплодия, а также увеличивать количество спонтанных беременностей у их партнеров.
Ключевые слова: мужское бесплодие, олигозооспермия, астенозооспермия, олигоастенозооспермия, Сперотон
Авторы заявляют об отсутствии конфликта интересов. Для цитирования: Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А. Эффективность применения комплекса Сперотон при мужском факторе бесплодия. Урология. 2018;3:00–00.
Doi: https: //dx.doi.org/10.18565/urology.2018.3.00-00
Введение
В 2015 году Росстат опубликовал демографический прогноз до 2050 года, по данным которого население страны может сократиться более чем на 14 млн. человек. Численность населения, согласно данному прогнозу, с учетом миграционного прироста может уменьшиться на 20% [1-3]. Россия стоит перед угрозой быстрой депопуляции. В этих условиях охрана репродуктивного здоровья населения является одной из важнейших государственных задач.
По данным Европейской ассоциации урологов у 50% невольно бездетных пар имеет место фактор мужского бесплодия, который ассоциируется с аномальными показателями спермограммы [1, 2]. С 1980 г. отмечено четырехкратное увеличение количества мужчин, обратившихся по поводу патоспермии [3].
Известно, что оплодотворяющая способность сперматозоидов зависит от секреторной активности вспомогательных половых желез: придатков яичек, простаты и семенных пузырьков [4-6]. Нарушение функции этих органов способно приводить к снижению количественных и функциональных показателей эякулята: концентрации, подвижности и морфологии сперматозоидов [7]. Одной из основных причин, приводящих к нарушению мужской репродуктивной функции, считают избыточную продукцию активных форм кислорода (АФК) [4, 7].
Хотя наличие свободных радикалов в сперматозоидах обнаружили еще в 1943 г., их роль в мужской репродуктивной физиологии изучили только в 1989 г. Известно, что в результате воздействия на организм мужчины различных негативных внутренних и внешних факторов происходит повышение генерации АФК [8]. При наличии небольшого количества АФК сохраняется нормальная функция сперматозоидов, возможна капацитация, гиперактивация, а также слияние с ооцитами и оплодотворение. Повышение количества свободных радикалов приводит к нарушению данных процессов [9].
Примерно от 40 до 80% мужчин с бесплодием имеют высокие уровни АФК. Появляется все больше доказательств того, что мощные антиоксиданты, содержащиеся в семенной плазме, защищают сперматозоиды от отрицательного воздействия свободных радикалов [10]. В том случае, когда количество свободных радикалов превышает антиоксидантные резервы организма, возникает окислительный стресс. Он существенно ухудшает сперматогенез [11]. Таким образом, при бесплодии, связанном с повышенным уровнем кислородных радикалов в сперме, отмечается терапевтический эффект антиоксидантов.
Одним из наиболее важных биохимических маркеров нормального созревания сперматозоидов является L-карнитин, продуцируемый придатком яичка [9, 10]. Физиологическая роль придатка яичка заключается в создании условий для нормального развития сперматозоидов путем секреции ряда соединений, в т. ч. L-карнитина, участвующего в переносе ацилгруппы и окислительного фосфорилирования жирных кислот в митохондриях, и, как следствие, обеспечении энергией, используемой сперматозоидами для созревания и активной подвижности. L-карнитин принимает участие в защите клеточной мембраны от свободных радикалов. Помимо L-карнитина качество спермы также зависит от поступления в организм витаминов и некоторых аминокислот [11].
Доказано, что прием витамина Е уменьшает тяжесть окислительного стресса в ткани яичек, повышает подвижность сперматозоидов и положительно влияет на их способность проникать в яйцеклетку [11-13]. Витамин E обладает эффектом синергизма с селеном, т. е. при одновременном приеме эти вещества проявляют выраженную эффективность в более низких дозах, чем при употреблении по отдельности, за счет взаимного предотвращения окисления (разрушения) как в кишечнике, так и в тканях.
Цинк – жизненно важный микроэлемент, который можно обнаружить практически в любых тканях организма [12, 13]. Цинк абсолютно необходим для клеточного дыхания, утилизации кислорода, воспроизведения генетического материала (ДНК и РНК), поддержания целости клеточных стенок и обезвреживания свободных радикалов. В организме человека цинк концентрируется во всех органах и тканях, в т. ч. в яичках, придатках яичек, предстательной железе, в достаточно большом количестве содержится в сперме. Он запускает и поддерживает процессы синтеза мужского полового гормона – тестостерона и активизирует сперматогенез. Цинк активирует глутатионпероксидазу, которая необходима для нормального созревания и подвижности сперматозоидов, а также участвует в регуляции активности ферментов спермы, способствует регуляции процессов разжижения эякулята и агглютинации.
Учитывая современные тенденции развития медицины, связанные с недостаточной эффективностью общепринятых методов терапии, постоянно ведется поиск альтернативных стратегий лечения в урологии и андрологии [12-16]. В связи с этим, широкое применение нашли многокомпонентные биологически активные комплексы [12, 13]. В настоящее время, патогенетически обоснованным принципом терапии инфертильности у мужчин является коррекция окислительного стресса, восполнение витаминов, микроэлементов и низкомолекулярных пептидов [11]. С этой целью обоснованным, с точки зрения его состава, является применение комплекса Сперотон.
Цель исследования:
оценить влияние комплекса Сперотон на функциональные характеристики сперматозоидов и фертильность мужчин с патозооспермией.
Материалы и методы
Нами было обследовано 60 мужчин с диагностированным мужским бесплодием на фоне различных нарушений сперматогенеза. Возраст от 25 до 40 лет.
При отборе пациентов учитывались следующие критерии включения: патоспермия (олигозооспермия, астенозооспермия, олигоастенозооспермия) по данным спермограмм, концентрация сперматозоидов не менее 10 млн/мл, отсутствие эякуляторных нарушений, отсутствие предшествующей терапии по поводу бесплодия (в том числе гормональной), отказ от приема сопутствующей медикаментозной терапии на период исследования, отсутствие женского фактора бесплодия у партнерши по результатам осмотра гинеколога.
Критериями исключения служили: наличие врожденных аномалий развития МПС, онкологические и тяжелые сердечно-сосудистые заболевания, сахарный диабет, гипогонадизм, генетические заболевания, лабораторные и клинические признаки инфекционно-воспалительных заболеваний органов МПС, ЗППП.
Пациенты были рандомизированы на 2 группы по 30 человек:
В контрольной группе (КГ) проводилась общая терапия (занятия спортом, отказ от курения и употребления алкоголя, соблюдение режима сна/бодрствования, регулярная половая жизнь, сбалансированное питание, при необходимости коррекция массы тела в соответствии с антропометрическими данными).
В основной группе (ОГ) в сочетании с общей терапией пациенты получали Сперотон в дозировке по 1 саше 1 раз в день в течение трех месяцев.
Обследование мужчин проводилось в ходе 4 визитов. При первом визите (В1) оценивался исходный статус пациентов, соответствие критериям включения и выявление критериев исключения. Дальнейшая оценка эффективности терапии проводилась ежемесячно со второго по четвертый визит (В2-В4). Оценивались показатели спермограммы в соответствии с критериями ВОЗ: концентрация, подвижность, количество сперматозоидов с нормальной морфологией, объем и время разжижения эякулята, проводился биохимический анализ эякулята с определением в нем уровня фруктозы и цинка. Также, учитывались случаи наступления спонтанной беременности у партнерши.
Статистическая обработка результатов проводилась с помощью программы MS Exel 11.0 из стандартного пакета MS Office 2013, а также программного обеспечения IBM SPSS Statistics 21.0. При проверке статистических гипотез применялись методы параметрической (t-test Cтьюдента) статистики. При оценке достоверности выявленных различий между средними значениями выборок рассчитывали параметр р, вероятность справедливости нулевой гипотезы была принята равной 5% (р<0,05).
Результаты
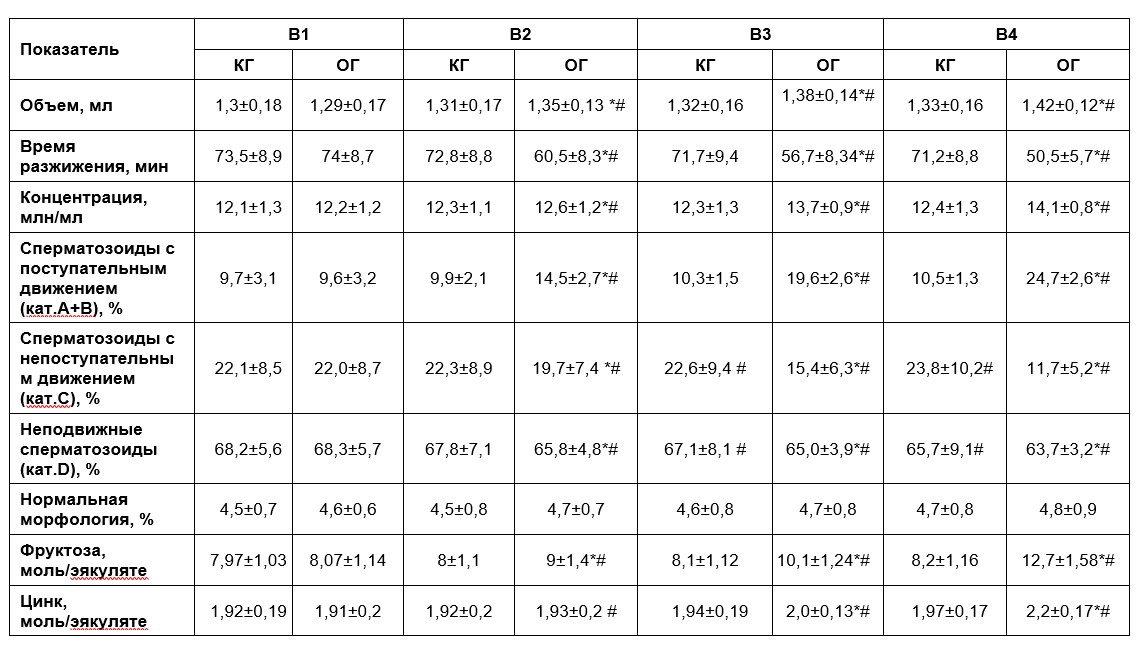
Согласно полученным данным, исходно у всех пациентов были выявлены олигозооспермия, астенозооспермия и олигоастенозооспермия, группы были однородными. В ходе проведенной терапии у пациентов отмечалась различная динамика изменения показателей спермограммы в двух группах, которая отражена в таблице 1.
Через месяц после начала терапии (В2) в КГ не было выявлено достоверных изменений исследуемых показателей (см. таблицу). В ОГ среднее значение объема эякулята увеличилось с 1,29±0,17 до 1,35±0,13 мл, что достоверно больше, чем в КГ. Время разжижения в ОГ значимо уменьшилось и составило 60,5±8,3 мин, что также достоверно отличалось от показателя контрольной группы. Сходная динамика отмечена и при сравнении концентрации сперматозоидов у пациентов двух групп. Среднее значение данного показателя составило 12,6±1,2 млн/мл и достоверно отличалось как от исходного значения, так и от результата в контрольной группе.
При анализе подвижности сперматозоидов, была отмечена тенденция к ее повышению в обеих группах. Тем не менее, достоверные изменения были выявлены только в группе пациентов, принимавших Сперотон. В ней количество сперматозоидов (категории А + В) с поступательным движением увеличилось в 1,5 раза с 9,6 ± 3,2% до 14,5 ± 2,7%, а количество сперматозоидов с непоступательным движением (категория С) и неподвижных сперматозоидов (категория D) снизилось до 19,7 ± 7,4% и 65,8 ± 4,8% соответственно (см. таблицу).
Анализ морфологии сперматозоидов достоверных изменений не выявил. Количество сперматозоидов с нормальной морфологией варьировало в пределах нормальных значений в обеих группах пациентов.
При биохимическом исследовании эякулята уровень фруктозы значимо повысился только в основной группе и составил 9 ± 1,35 ммоль. Уровень цинка в группах достоверно не отличался.
К концу второго месяца терапии (В3) динамика изменения показателей в группах сохранялась (см. таблицу). Достоверно увеличилась концентрация сперматозоидов, объем эякулята, а также снизилось время его разжижения в основной группе пациентов. Количество сперматозоидов категории А+В в данной группе за указанный срок выросло в 2 раза и составило 19,6 ± 2,6%, что также достоверно отличалось от показателя в КГ, который составил 10,3 ± 1,5% и значимо не отличался от предыдущего результата. В основной группе доля сперматозоидов категорий С и D достоверно уменьшилась. В контрольной группе указанные показатели также достоверно отличались от результатов визита 2 (В2), при этом количество сперматозоидов с непоступательным движением увеличилось до 22,6 ± 9,4%, а неподвижных сперматозоидов снизилось до 67,1 ± 8,1%.
Уровень фруктозы в эякуляте к визиту 3 (В3) в основной группе достоверно увеличился до 10,1 ± 1,24 ммоль, а уровень цинка до 2,01 ± 0,13 ммоль. Динамика данных показателей в КГ была не значимой.
Через три месяца терапии (В4) в контрольной группе пациентов в сравнении с результатами визита 3 (В3) достоверно изменилось количество сперматозоидов категории С и категории D (см. таблицу). Их значения составили 23,8 ± 10,2% и 65,7 ± 9,1% соответственно. При анализе остальных исследуемых показателей в данной группе значимых изменений выявлено не было.
В ОГ отмечалась достоверная положительная динамика большинства показателей: концентрации и подвижности сперматозоидов, объема и времени разжижения эякулята (таб.1). Среднее значение содержания фруктозы увеличилось в 1,6 раз в сравнении с исходным показателем и составило 12,7 ± 1,58 ммоль, а уровень цинка за три месяца вырос на 15% – до 2,2 ± 0,17 ммоль. Значения всех исследуемых показателей после трех месяцев терапии (В4) в группе пациентов, принимавших Сперотон были близки к нормальным.
В КГ за весь период наблюдения не было выявлено случаев беременности, тогда как на фоне приема комплекса Сперотон в четырех семейных парах была зафиксирована спонтанная беременность. В целом к окончанию 3-месячной терапии в обеих группах отмечено значительное улучшение всех исследуемых показателей по сравнению с исходными значениями. Тем не менее в ОГ пациентов динамика оказалась статистически значимо более выраженной, что свидетельствует о большей эффективности проводимого лечения. Согласно полученным данным, применение комплекса Сперотон позволило увеличить объем эякулята на 10%, концентрацию сперматозоидов – на 15,6%, уменьшить время разжижения на 32%. Доля сперматозоидов с поступательным движением (категории А+В) увеличилась в 2,6 раза за счет активизации сперматозоидов категории C. Это, на наш взгляд, может быть связано с изменением ферментного состава эякулята, что косвенно подтверждается повышением уровня фруктозы в 1,6 раза, а также увеличением количества цинка на 15% в биохимическом анализе спермы, которое в свою очередь свидетельствует о высокой биодоступности Сперотона. Кроме того, применение данного комплекса позволило увеличить концентрацию сперматозоидов у пациентов основной группы, что может быть обусловлено влиянием его компонентов на антиоксидантную защиту организма и процесс сперматогенеза путем активации ферментативных реакций, метаболических процессов и стимуляции выработки гормонов. Однако данные механизмы требуют более углубленного изучения в ходе дальнейших исследований. Эффективность терапии пациентов, проведенной в ОГ, также подтверждается четырьмя случаями спонтанной беременности, которая наступила на фоне качественных изменений показателей спермы.
Заключение
Таким образом, применение Сперотона позволяет повышать подвижность и концентрацию сперматозоидов у пациентов с мужским фактором бесплодия, приближать их к нормальным значениям, а также увеличивать количество спонтанных беременностей у их партнеров. Мы рекомендуем применение комплекса Сперотон данной категорией больных с целью коррекции нарушений сперматогенеза.
Таблица. Показатели спермограммы пациентов в течение 3-месячного курса терапии
Примечание
Статистическая значимость различий:
* – по сравнению с контрольной группой,
# – по сравнению с результатами предыдущего визита при p<0,05.
Список литературы:
- Урология. Российские клинические рекомендации. Под ред. Аляева Ю.Г., Глыбочко П.В., Пушкаря Д.Ю. – М.: ГЭОТАР-Медиа, 2015.– 480 с.
- Stone В.А. Age thresholds for changes in semen parameters in men./ В.А. Stone, A. Alex, L.B. Werlin, R.P. Marrs // Fert and Ster. – 2013. – Vol. 100(4). – P. 952–958.
- Енькова Е.В. Мужской фактор невынашивания беременности/ Е.В. Енькова, А.В. Кузьменко, О.В. Хоперская, О.В. Гайская, Т.А. Гяургиев// Системный анализ и управление в биомедицинских системах. – 2017. – №3. – Т.16. – С.555-564.
- Нашивочникова Н.А. Антиоксидантная терапия бесплодного брака / Н.А. Нашивочникова, В.Н. Крупин, С.А. Селиванова // Урология. – 2015. – № 3. – С. 71-74.
- Кузьменко А.В. Комбинированная медикаментозная терапия больных с ДГПЖ / А.В. Кузьменко, В.В. Кузьменко, Т.А. Гяургиев // Урология. - 2018. - № 1. - С. 101-105.
- Кузьменко А.В. Хронобиологический статус больных с хроническим простатитом на фоне аденомы простаты / А.В. Кузьменко, В.В. Кузьменко, Т.А. Гяургиев, И.И. Баранников //Системный анализ и управление в биомедицинских системах. - 2017. – Т.16. №3. – С. 513-516.
- Божедомов В.А., Торопцева М.В., Ушакова И.В. Спориш Е.А., Ловыгина Н.А., Липатова Н.А. Активные формы кислорода и репродуктивная функция мужчин: фундаментальные и клинические аспекты (обзор литературы). Андрол. и генит. хир. 2011;3:10–16.
- Tremellen K. Oxidative stress and male infertility – a clinical perspective/ K. Tremellen // Hum Reprod Update. – 2008. – Vol. 14. – Р. 243-258.
- Agarwal A., Makker K., Sharma R. Clinical relevance of oxidative stress in male factor infertility: an up-date // Am J Reprod Immunol. 2008. Vol. 59. Р. 2–11.
- Виноградов И.В., Блохин А.В, Афанасьева Л.М., Габлия М.Ю. Опыт применения L-карнитина в лечении секреторного бесплодия. Андрол. и генит. хир. 2009;3:2–8.
- St. Steinbrenner H. Dietary selenium in adjuvant therapy of viral and bacterial infections/ H. St. Steinbrenner, S. Al-Quraishy, M.A. Dkhil et al. // Adv Nutr. – 2015. – Vol. 6(1). – Р. 73–82.
- Кузьменко, А.В. Хронобиологические аспекты применения пролита супер септо у больных инфекционно-воспалительными заболеваниями органов мочевыделительной системы/ А.В. Кузьменко [и др.]// Урология. – 2015. - №4. – С. 19-23
- Кузьменко, А.В. Хронобиологические аспекты применения комплекса «Нейродоз» у больных с эректильной дисфункцией/ А.В. Кузьменко [и др.]//Урология. - 2014. - №5. – С. 90-94.
- Кузьменко А.В. Хронобиологический подход к терапии хронического рецидивирующего бактериального цистита в стадии обострения / А.В. Кузьменко, В.В. Кузьменко, Т.А. Гяургиев // Урология. - 2017. – №2. – С. 60-65.
- Гяургиев Т. А. Морфометрический анализ эффективности хронотерапии и фототерапии в лечении больных хроническим рецидивирующим бактериальным циститом в стадии обострения / Т.А. Гяургиев, А.В. Кузьменко, А.Л. Лавренов // Системный анализ и управление в биомедицинских системах. – 2015 - Т14, №3 – С. 477-481.
- Гяургиев Т. А. Лечение больных с хроническим рецидивирующим циститом в стадии обострения в комплексе с фототерапией с использованием аппарата «Светозар»/ Т.А. Гяургиев, А.В. Кузьменко, В.М. Вахтель, П.А. Лукъянович// Системный анализ и управление в биомедицинских системах. – 2014 - Т13, №4 – С. 821-824.
References:
- Urology. Russian clinical recommendations / ed. by Yu. G. Alaev, P. V. Glybochko, D. Yu. Pushkar - M.: GEOTAR-Media, 2015.- 480s.
- Stone V. A. Age threshold for changes in semen parameters in men./ V. A. Stone, A. Alex, L. B. Werlin, R. P. Marrs // Fert and Ster. - 2013. - Vol. 100 (4). - P. 952-958.
- Yen'kova E. V. Male factor of miscarriage/ yen'kova E. V., A.V. Kuz`menko, O. V. Hoperskaya, O. V. Gai, T. A. Gyaurgiev// System analysis and management in biomedical systems. - 2017. – No. 3. - T. 16. – P. 555-564.
- Nashivochnikov N.. Antioxidant therapy for infertile marriage / N.. Nashivochnikov, V. N. Krupin, S. A. Selivanov // Urology. - 2015. – No. 3. – P. 71-74.
- Kuz`menko A. V. Combined drug therapy of patients with BPH / A. V. Kuz`menko, V. V. Kuz`menko, T. A. Gyaurgiev // Urology. - 2018. - No. 1. - P. 48-52.
- Kuz`menko A. V. Chronobiological status of patients with chronic prostatitis on the background of benign prostatic hyperplasia / A. V. Kuz`menko, V. V. Kuz`menko, T. A. Gyaurgiev, I. Barannikov //System analysis and management in biomedical systems. - 2017. - T. 16. No. 3. - P. 513-516.
- Bozhedomov V. A., Toroptseva M. V., Ushakova I. V. Sporish E. A., Lovygina N. Ah. Lipatova N. Ah. Active forms of oxygen and reproductive function of men: fundamental and clinical aspects (literature review). Androl. and genit. hir. 2011;3: 10-16.
- Tremellen K. Oxidative stress and male infertility – a clinical perspective/ K. Tremellen // Hum Reprod Update. - 2008. - Vol. 14. - R. 243-258.
- Agarwal A., Maker K., Sharma R. Clinical relevance of oxidative stress in male factor infertility: an up-date // Am J Reprod Immunol. 2008. Vol. 59. R. 2-11.
- Vinogradov I. V., Blokhin A., Afanasyev L. M., M. Y. Gable experience with the use of L-carnitine in the treatment of secretory infertility. Androl. and genit. hir. 2009;3: 2-8.
- St. Steinbrenner H. Dietary selenium in adjuvant therapy of viral and bacterial infections/ H. St. Steinbrenner, S. Al-Quraishy, M. A. Dkhil et al. // Adv Nutr. - 2015. - Vol. 6 (1). - P. 73-82.
- Kuz`menko A. V. Chronobiological aspects of the use of prolit super septo in patients with infectious-inflammatory diseases of the urinary system/ A. V. Kuz`menko [et al.]// Urology. - 2015. - No. 4. – S. 19-23
- Kuz`menko A. V. Chronobiological aspects of the use of complex "Neurodes" in patients with erectile dysfunction/ A. V. Kuz`menko [et al.]//Urology. - 2014. - No. 4. – S. 312-315.
- Kuz`menko A. V. Chronobiological approach to the treatment of chronic recurrent bacterial cystitis in the acute stage / A. V. Kuz`menko, V. V. Kuz`menko, T. A. Gyaurgiev // Urology. - 2017. – No. 2. - P. 60-65.
- Gyaurgiev T. A. Morphometric analysis of the effectiveness of chronotherapy and phototherapy in the treatment of patients with chronic recurrent bacterial cystitis in the acute stage/ T. A. Gyaurgiev, A. V. Kuz`menko, A. L. Lavrenov // System analysis and management in biomedical systems.– 2015 – T14, Number 3, Pp. 477-481.
- Gyaurgiev T. A. Treatment of patients with chronic recurrent cystitis in the acute stage in combination with phototherapy using the apparatus "Svetozar"/ Gyaurgiev T. A., A. V. Kuz`menko, V. M. Wachtel, P. A. Lukyanovich// System analysis and management in biomedical systems. – 2014 - T13, No. 4 – Pp. 821-824.
Автор для связи:
Кузьменко Андрей Владимирович - доктор медицинских наук, доцент, зав. кафедрой урологии ФГБОУ ВО ВГМУ им. Н.Н. Бурденко; тел. 8 903 653 05 94 ; e-mail: Kuzmenkoav09@yandex.ru.
Corresponding author:
Kuz`menko Andrey Vladimirovich - PhD in Medical Sciences, head of the Urology department Voronezh State Medical University n.a. N.N. Burdenko; tel. 8 903 653 05 94; e-mail: Kuzmenkoav09@yandex.ru.
Сведения об авторах
Кузьменко Владимир Васильевич -доктор медицинскихнаук, профессор, профессор кафедры урологии ФГБОУ ВО ВГМУ им. Н.Н. Бурденко; тел. 8 910 749 71 33
e-mail:Kuzmenkovv2003@mail.ru.
Гяургиев Тимур Асланбекович – ассистент кафедры урологии ФГБОУ ВО ВГМУ им. Н.Н. Бурденко; тел. 8 920 454 22 29; e-mail:tima001100@mail.ru
Источник изображений на данной странице – Shutterstock / Fotodom.
