А.И. Давыдов, Р.А. Чилова, В.А .Лебедев, М.Б. Таирова
Первый Московский государственный медицинский университет им. И.М.Сеченова (Сеченовский Университет), Москва, Российская Федерация
Выполнен анализ перекисного окисления липидов и антиоксидантной защиты (концентрация α-токоферола и супероксиддисмутазы) в сыворотке крови больных аденомиозом. До лечения (органосберегающая эндохирургия + медикаментозная терапия) содержание диеновых конъюгатов, малонового диальдегида, супероксиддисмутазы, α-токоферола достоверно превышали показатели в контрольной группе (пациентки с бесплодием трубного генеза). При этом активность супероксиддисмутазы была почти в 2 раза ниже, а уровень малонового диальдегида – в 2 раза выше в сравнении с нормативными значениями. Всем пациенткам после операции назначали прогестагены, препараты магния, индол-3-карбинол + ресвератрол (1 таблетка 1 раз в день в течение 3 мес.) После комплексного лечения все показатели свободнорадикальных процессов и антиоксидантной защиты существенно изменились: они не достигли контрольных значений, но приблизились к ним настолько, что разница различий между содержанием малонового диальдегида, диеновых конъюгатов, супероксиддисмутазы, α-токоферола в сыворотке крови женщин контрольной группы и пациенток с аденомиозом оказалась недостоверной, причем процент вариаций (улучшения) диеновых конъюгатов и супероксиддисмутазы превысил 40%.
Заключение. При наличии определенных условий внутриматочная эндохирургия в комплексе с послеоперационным медикаментозным лечением позволяет обеспечить долговременное купирование патогномоничных симптомов аденомиоза.
Ключевые слова: аденомиоз, репродуктивный возраст, антиоксидантная система, индол-3-карбинол, ресвератрол
В июле 2018 г. Всемирная организация здравоохранения (ВОЗ) приняла обновленный Международный классификатор болезней 11-го пересмотра (ICD-11 for Mortality and Morbidity Statistics). В этом классификаторе в сравнении с предыдущей версией (МКБ-10) имеются принципиальные изменения, в том числе касающиеся частой и сложной патологии матки – аденомиоза (GA11 Adenomyosis). В ICD-11 (version 05/2021) указывается, что аденомиоз относится к невоспалительным нарушениям женских половых органов и характеризуется ростом эндометриальной ткани в миометрий, гипертрофией миометрия, обильным или продолжительным менструальным кровотечением, дисменорей, диспареунией, кровотечением между менструациями, бесплодием или асимптоматическим течением; верифицируется гистологически или с помощью ультрасонографии [1]. Примечательно, что в обновленном классификаторе аденомиозу отводится отдельная рубрика – GA11, в то время как эндометриоз классифицируется вне связи с аденомиозом – GA10 Endometriosis.
Сегодня термин «аденомиоз» фигурирует сравнительно часто в заключениях ультразвукового исследования и магнитно-резонансной томографии. При этом превалирует диагноз «аденомиоз 1-й степени». Мы неоднократно указывали, ссылаясь на работы ведущих патологов [2, 3], что так называемый аденомиоз 1-й степени (смещение базальных слоев эндометрия в миометрий на глубину 2,1 мм) – это не что иное, как физиологическая ретракция базальной мембраны, преимущественно после родов [4]. Более того, ни в одной международной классификации, включая гистологическую классификацию опухолей женских репродуктивных органов (ВОЗ, 2014) не выделяются стадии аденомиоза. Общепризнано, что для гистологической верификации аденомиоза необходимо идентифицировать зону поражения мышечной ткани матки на глубине не менее 2,5 мм от уровня базальной мембраны [2, 3, 5], а согласно ICD-11 обязательным признаком аденомиоза является гипертрофия миометрия – увеличение хотя бы одного размера тела матки. В практике нередко можно встретить описание ультразвуковых и/или магнитно-резонансных «признаков» аденомиоза с указанием нормальной величины тела матки.
К сожалению, в мире до сих пор не существует классификации аденомиоза, приемлемой как для клиницистов, так и патологоанатомов. В 2011 г. Международная федерация акушеров-гинекологов (International Federation of Gynecology and Obstetrics/FIGO) утвердила классификацию аномальных маточных кровотечений (abnormal uterine bleeding/AUB) под аббревиатурой PALM-COIEN, в которой AUB-A означает аденомиоз [6]. Следовательно, в классификаторе FIGO подчеркивается, что аденомиоз, прежде всего, – заболевание с яркой клинической картиной, в которой преобладают AUB по типу меноррагий и железодефицитная анемия.
Несмотря на все перипетии в отношении терминологии и диагностики аденомиоза [7–9], следует признать, что его частота за последние десятилетия возросла и он все чаще регистрируется у женщин до 40 лет. Такая ситуация диктует необходимость разработки новых и совершенствования известных методов органосберегающего лечения больных аденомиозом репродуктивного возраста. С позиций гистогенеза аденомиоза (строма существенно превалирует над железистым эпителием и крайне слабо реагирует на экзогенные гормоны из-за отсутствия в ней рецепторов к половым стероидам), изолированная гормональная терапия аденомиоза малоэффективна и может лишь временно повысить качество жизни пациентки, но не в состоянии обеспечить регрессию заболевания [2, 3]. Ранее нами апробированы и модернизированы методики внутриматочной хирургии при аденомиозе в репродуктивном периоде, основанные на применении оперативной гистероскопии: глубокое иссечение видимых патологических очагов с захватом подлежащих мышечных слоев в комплексе с перевязкой нисходящих маточных артерий [4, 10]. Исследования по данной проблеме показали сравнительно высокую эффективность такого подхода при соблюдении ряда строгих условий и показаний. В то же время было доказано, что любое органосберегающее хирургическое лечение пациенток с аденомиозом должно сопровождаться комплексом послеоперационных консервативных мероприятий, включая гормональную и негормональную терапии. Послеоперационная гормональная терапия больных аденомиозом нами детально обсуждалась [9]. Однако у таких пациенток немаловажное значение имеет также коррекция антиоксидантной защиты, поскольку неудачи гормональной терапии аденомиоза связывают с нарушениями перекисного окисления липидов (ПОЛ) и антиоксидантного статуса этих больных [11, 12].
Известно, что ПОЛ является физиологическим процессом, необходимым для сохранения гомеостаза организма и его нормального функционирования. Организм отвечает на различные воздействия активацией процессов ПОЛ, которую можно рассматривать в качестве защитно-приспособительной реакции. Адекватность этой реакции контролируется в организме активацией системы антиоксидантной защиты (АОЗ), что, в свою очередь, обеспечивает нормальный стабильный уровень ПОЛ. Если по каким-либо причинам системы АОЗ оказываются функционально неполноценными, ПОЛ превращается в фактор поражающего действия и тем самым становится патогенетическим фактором развития различных патологических форм.
Существует обратная связь между активностью антиоксидантной системы (АОС) и содержанием продуктов ПОЛ, которую рассматривают как универсальный процесс, ответственный за повреждение мембран, клеточных, генетических структур, ферментных систем. С процессом ПОЛ непосредственно связаны скорость клеточного деления, состояние окислительного фосфорилирования, регуляция проницаемости мембран, синтез простагландинов и стероидных гормонов, функция ферментативных систем.
Считается, что деятельность клеток и тканей организма человека обеспечивается окислительно-восстановительным гомеостазом. Его смещение в «прооксидантную» сторону под действием экзогенных и эндогенных факторов приводит к возникновению окислительного стресса, следствием которого является повреждение клеточных и генетических структур. Скорость и регуляция ПОЛ осуществляются многокомпонентной АОС, включающей антикислородную, антирадикальную, антиперекисную защиты. АОС обеспечивает связывание и модификацию свободных радикалов, предупреждение образования и разрушение перекисей, экранирование функциональных групп белков и других биомолекул. Стабилизацию процессов ПОЛ может вызвать усиление как ферментативного, так и неферментативного звеньев АОЗ – тиосульфат натрия, токоферолы, стероидные гормоны, витамины А, К, Р [13–15].
Ферментативное звено АОС представлено антирадикальными и антиперекисными ферментами (супероксиддисмутаза (СОД), каталаза, глутатионпероксидаза и др.), а также оксидоредуктазами (глутатионредуктаза и др.), которые ингибируют реакции свободно-радикального окисления. СОД относится к числу важных ферментативных антиоксидантов. Широкое участие супероксидных радикалов в ферментативных реакциях синтеза простагландинов, интерлейкинов и метаболизма ксенобиотиков, а также клеточной пролиферации и экспрессии определенных генов позволяет рассматривать СОД как ключевой фермент, выполняющий не только защитную, но и регуляторную функции [16].
В норме ПОЛ характеризуется небольшой выраженностью и достаточной стабильностью, не меняется в различные фазы менструального цикла. При клинически активных формах аденомиоза усиливаются процессы ПОЛ и снижается активность СОД. Последнее обусловлено депрессией системы АОЗ, что наблюдается при наиболее тяжелых и распространенных процессах. У больных активным аденомиозом развивается определенная резистентность к воздействию патологических метаболитов в результате возникновения компенсаторных реакций. Значительное нарастание в крови больных с активным аденомиозом промежуточных метаболитов пероксидации в определенной мере отражает модификацию клеточных мембран, и такие последствия обусловлены несостоятельностью АОС.
Нами проведена оценка ПОЛ и АОЗ (концентрация α-токоферола и СОД) в сыворотке крови больных аденомиозом. Для оценки активности ПОЛ определяли содержание первичных и вторичных продуктов окисления свободных жирных кислот – диеновых конъюгатов (ДК) и малонового диальдегида (МДА). Учитывая вариации активности процессов ПОЛ и АОЗ в крови женщин в течение менструального цикла, исследования выполняли на 20–24-й дни цикла. Забор крови пациенток производился натощак из локтевой вены до хирургического лечения и через 3 мес. после операции.
До лечения в сыворотке крови больных аденомиозом содержание МДА, ДК, СОД, α-токоферола достоверно превышало показатели в контрольной группе (пациентки с бесплодием трубного генеза). При этом активность СОД была почти в 2 раза ниже, а уровень МДА – в 2 раза выше в сравнении с нормативными значениями.
Всем пациенткам в послеоперационном периоде помимо традиционной терапии (по показаниям – анальгетики, спазмолитики и антимикробные средства) назначали прогестагены с антипролиферативной активностью в отношении эндометриоидных гетеротопий, препараты магния, а также индол-3- карбинол + ресвератрол – Имастон (АО «Аквион»). Последнее средство является биологически активной добавкой, включающей в себя одновременно два компонента: индол-3-карбинол (200 мг) – соединение с многогранным антипролиферативным эффектом и ресвератрол (60 мг) – антиоксидант, фитоалексин из класса полифенольных соединений. Имастон назначали по 1 таблетке 1 раз в день в течение 3 мес.
Антипролиферативные свойства индол-3-карбинола хорошо известны:
- нормализация метаболизма эстрадиола;
- подавление синтеза 16α-гидроксиэстрона – онкопротективное действие;
- ингибирование ростовых факторов, ответственных за избыточную пролиферацию клеток;
- уменьшение концентрации эстрогеновых рецепторов в тканях-мишенях;
- ингибирование инвазии, ангиогенеза [18, 19].
Ресвератрол обладает выраженной антиоксидантной активностью и способностью селективно индуцировать апоптоз. Помимо этого, антипролиферативный эффект ресвератрола заключается в подавлении выработки факторов роста и цитокинов. Ресвератрол модулирует метаболизм эстрогенов, нивелируя их канцерогенные свойства и, таким образом, существенно усиливает действие прогестагенов [20]. Установлено, что для ресвератрола не характерны эмбриотоксические и тератогенные эффекты [21].
В нашем исследовании показания к применению антиоксидантов основывались на результатах биохимических исследований, которые свидетельствовали об исходных нарушениях процессов свободнорадикального ПОЛ и АОЗ у больных аденомиозом (таблица).
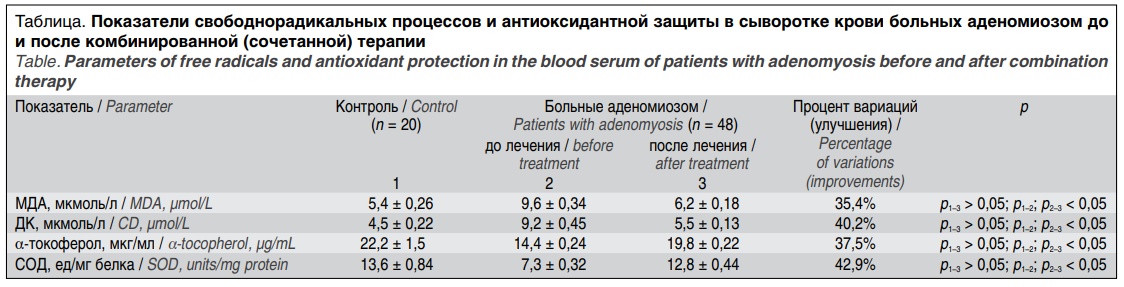
Как следует из таблицы, после комплексного лечения все исследуемые показатели свободнорадикальных процессов и АОЗ существенно изменились: они не достигли контрольных значений, но приблизились к ним настолько, что разница различий между содержанием МДА, ДК, СОД, α-токоферола в сыворотке крови женщин контрольной группы и пациенток с аденомиозом оказалась недостоверной, причем процент вариаций (улучшения) ДК и СОД превысил 40%.
Обсуждение
С позиций патогенеза аденомиоза его развитие рассматривается как метапластическая реакция в ответ на врастание желез и стромы базальной мембраны в мышечный слой матки. Естественно, это не может не сопровождаться формированием защитных эффектов адаптации, сопровождающейся изменением метаболизма клеток. Эти процессы вызывают стандартную стресс-реакцию. При кратковременном действии стрессов умеренной интенсивности происходит усиление функционирования органов и мобилизация организма. Однако при интенсивной или длительной стрессреакции в клетках происходит активация процесса свободнорадикального окисления, внутриклеточная кальциевая перегрузка, угнетение энергопродукции, снижение синтеза белка и денатурация белковых структур. Это оказывает повреждающее воздействие на органы, ткани, и, таким образом, стресс-реакция из звена адаптации трансформируется в звено патогенеза. Одним из возможных компонентов быстрой реакции на стресс является активация ПОЛ. Известно, что в нормальных условиях жизнедеятельности клетки постоянно присутствует определенный уровень ПОЛ, индуцированный образованием активных форм кислорода.
ПОЛ в клетке поддерживается на постоянном уровне благодаря многоуровневой антиоксидантной системе защиты. Таким образом, сбалансированность между обеими частями этой системы – перекисным окислением и антиоксидантной активностью – является необходимым условием для поддержания нормальной жизнедеятельности клетки. Учитывая необходимость сохранения прооксидантно-антиоксидантного равновесия в стационарном режиме, можно предположить, что его смещение является одним из первых неспецифических звеньев в развитии стресс-реакции и может служить тем биологически важным изменением внутренней среды клетки, которое запускает другие механизмы защиты. Продукты ПОЛ могут являться как индукторами, так и первичными медиаторами стресса.
Анализ результатов биохимических исследований обнаружил повышенную концентрацию в крови больных аденомиозом промежуточных метаболитов пероксидации. Учитывая изложенное выше, увеличение концентрации продуктов ПОЛ в крови больных аденомиозом в определенной мере отражает модификацию клеточных мембран в данных условиях. Вероятно, что такая реакция обусловлена несостоятельностью АОС, вызванной истощением ее резервов. Поэтому в комплекс лечения пациенток с аденомиозом помимо главного звена – эксцизии патологических очагов – необходимо включать средства, улучшающие АОЗ организма.
Увеличение концентраций продуктов ПОЛ в крови пациенток с аденомиозом, по-видимому, отражает модификацию клеточных мембран, вызванную несостоятельностью АОС. Это диктует необходимость включения в комплекс методов послеоперационной терапии антиоксидантных средств и препаратов магния. Их применение в комплексе лечения больных аденомиозом способствовало значительному улучшению показателей ПОЛ и АОЗ, по отдельным тестам (ДК и СОД) более чем на 40%.
Важным компонентом успеха лечения больных аденомиозом репродуктивного возраста, когда необходимость сохранения детородной функции и анатомо-физиологический отношений матки и яичников по праву считается главной целью современной медицины, является рациональный выбор корригирующей медикаментозной терапии. В литературе имеется большое количество работ, посвященных использованию антипролиферативного эффекта индол-3-карбинола при аденомиозе [22, 23]. Действительно, это соединение позволяет существенным образом дополнить и усилить деактивацию патологических очагов в миометрии, а также сбалансировать функционирование системы гипотламус–гипофиз–яичники. Однако у пациенток с аденомиозом не менее важен выбор эффективного средства, улучшающего работоспособность АОС. Антиангиогенный антиоксидант ресвератрол (полифенол) не только снижает оксидативный стресс, но и нормализует процессы апоптоза и пролиферации клеток (уменьшает эстрогенную активность), а также обладает противовоспалительным действием вследствие подавления продукции провоспалительных цитокинов [24].
Заключение
Несмотря на многочисленные публикации, терминология эндометриоидного поражения матки в отечественной литературе по-прежнему вызывает много вопросов и нареканий. Во-первых, это связано с тем, что мы до сих пор работаем по МКБ-10, который нужно признать морально устаревшим (история этого классификатора начинается с 1988 г.). Во-вторых, в принятой в нашей стране классификации аденомиоза (или эндометриоза матки согласно МКБ-10) заложены основы гистологической классификации, разработанной еще в советский период (в 1980 г.) известным ученым Б.И.Железновым [26]. Именно Б.И.Железнов ввел в оборот термин «внутренний эндометриоз 1-й стадии», указав, что 1-я степень заболевания – это прорастание слизистой на глубину одного поля зрения при малом увеличении светового микроскопа (2,1 мм). В клинических рекомендациях Минздрава России «Эндометриоз» (2020) дается следующее определение аденомиозу 1-й стадии – патологический процесс ограничен подслизистой оболочкой тела матки. Однако не совсем понятно, что составители рекомендаций подразумевали под термином «подслизистая оболочка тела матки», который не согласуется с общепризнанными представлениями о гистологии матки. Если речь идет о собственной пластинке слизистой (базальная мембрана), которая является физиологическим компонентом эндометрия, то она не может трансформироваться в эндометриоидноподобную ткань, поскольку сама является истинной эндометриальной тканью.
В мировой литературе уже на протяжении свыше 20 лет [26] принято считать аденомиозом обнаружение патологических очагов в миометрии на глубине не менее 2,5 мм от уровня базальной мембраны, а по мнению ряда авторов – даже свыше 4 мм [5]. Ближайший ученик и последователь Б.И.Железнова профессор Н.И.Кондриков в своей монографии «Патология матки» (2008) [2] вполне однозначно дал морфологическое определение аденомиозу: «…опухолеподобное состояние, при котором железы эндометриального типа с окружающей их цитогенной стромой располагаются в миометрии … на глубине ниже 2,5 мм от уровня соединения эндо- и миометрия».
Гистологическая структура эндометриоидной ткани любой локализации предполагает обязательное присутствие в ней двух компонентов – железистого (эпителиального) и стромального. Цитогеннная строма является определяющей для постановки диагноза и при аденомиозе имеет свои особенности: в отличие от эндометриоза вследствие крайне скудности рецептивных белков не подвержена влиянию экзогенных гормонов, при том что в отличие от эндометриоза в очагах аденомиоза строма существенно превалирует над железистым эпителием. Из гистогенеза аденомиоза следует, что изолированное применение медикаментозных средств может лишь временно повысить качество жизни пациентки, но не в состоянии обеспечить долговременную регрессию заболевания. Поэтому патогенетическим методом лечения таких пациенток является хирургическое вмешательство. Безусловно, полное удаление всех очагов аденомиоза возможно только с помощью гистерэктомии. Однако радикальный подход абсолютно не приемлем у женщин репродуктивного возраста не только с позиций необходимости сохранения детородной функции, но и предупреждения развития тяжелой эндокринной патологии – постгистерэктомического синдрома [27]. Исследования, проведенные нами ранее, показали, что при наличии определенных условий внутриматочная эндохирургия в комплексе с послеоперационным медикаментозным лечением позволяет обеспечить долговременное купирование патогномоничных симптомов аденомиоза (аномальное маточное кровотечение, приводящее к развитию железодефицитной анемии; дисменорея; хроническая тазовая боль). В данной работе мы целенаправленно не обсуждаем вопросы выбора гормональных средств. Задача – акцентировать внимание практикующих врачей на важность включения в комплекс послеоперационной медикаментозной терапии антиоксидантных и антипролиферативных средств негормональной природы. Таким требованиям вполне отвечает комплекс индол-3-карбинол + ресвератрол, применение которого у пациентов с аденомиозом способствует одновременному решению ряда задач:
- усилению эффективности гормональных средств за счет снижения оксидативного стресса и уменьшения эстрогенной активности, а следовательно, и избыточной пролиферации в клетках миометрия;
- снижению провоспалительной нагрузки в зоне поражения [28];
- купированию важных клинических симптомов аденомиоза, ассоциированных с тазовой болью (дисменорея, диспареуния).
Представленная тактика лечения пациенток репродуктивного возраста с аденомиозом, верифицированным гистологическим исследованиям, позволяет не только сохранить анатомию органов малого таза у молодых женщин, но и обеспечить максимально благоприятные условия для последующего зачатия, что особенно важно в программах вспомогательных репродуктивных технологий.
Литература
- WHO. ICD-11 for Mortality and Morbidity Statistics. Available at: https://icd.who.int/browse11/l-m/en#/http%3a%2f%2fid.who.int%2ficd%2fentity%2f171294592
- Кондриков НИ. Патология матки. М.: Практическая медицина, 2008.
- Gershenson D, Fidel L, Lobo VR. Comprehensive Gynecology. 8th Edition. Elsevier, 2021.
- Давыдов АИ, Пашков ВМ, Шахламова МН. Аденомиоз: новый взгляд на старую проблему. Вопросы гинекологии, акушерства и перинатологии. 2016; 15(2):59-66. DOI: 10.20953/1726-1678-2016-2-59-66
- Ferenczy A. Pathophysiology of adenomyosis. Hum Reprod Update. 1998 JulAug;4(4):312-22. DOI: 10.1093/humupd/4.4.312
- Munro MG, Critchley HO, Broder MS, Fraser IS; FIGO Working Group on Menstrual Disorders. FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. Int J Gynaecol Obstet. 2011 Apr;113(1):3-13. DOI: 10.1016/j.ijgo.2010.11.011
- Chapron C, Vannuccini S, Santulli P, Abrão MS, Carmona F, Fraser IS, et al. Diagnosing adenomyosis: an integrated clinical and imaging approach. Hum Reprod Update. 2020 Apr 15;26(3):392-411. DOI: 10.1093/humupd/dmz049
- Van den Bosch T, de Bruijn AM, de Leeuw RA, Dueholm M, Exacoustos C, Valentin L, et al. Sonographic classification and reporting system for diagnosing adenomyosis. Ultrasound Obstet Gynecol. 2019 May;53(5):576-582. DOI: 10.1002/uog.19096
- Давыдов АИ, Пашков ВМ, Шахламова МН. Субмукозная миома матки в сочетании с аденомиозом. Принципы таргетной терапии в репродуктивном периоде. Вопросы гинекологии, акушерства и перинатологии. 2019;18(3): 124-132. DOI: 10.20953/1726-1678-2019-3-124-132
- Давыдов АИ, Таирова МБ, Михалёва ЛМ, Кавиладзе МГ, Чилова РА. Аденомиоз. Что изменилось с появлением МКБ-11? Вопросы гинекологии, акушерства и перинатологии. 2021;20(2):117-124. DOI: 10.20953/1726-1678-2021-2-117-124
- Xu W, Song Y, Li K, Zhang B, Zhu X. Quercetin Inhibits Adenomyosis by Attenuating Cell Proliferation, Migration and Invasion of Ectopic Endometrial Stromal Cells. Drug Des Devel Ther. 2020 Sep 21;14:3815-3826. DOI: 10.2147/DDDT.S265066
- Ota H, Igarashi S, Hatazawa J, Tanaka T. Immunohistochemical assessment of superoxide dismutase expression in the endometrium in endometriosis and adenomyosis. Fertil Steril. 1999 Jul;72(1):129-34. DOI: 10.1016/s0015- 0282(99)00152-1
- Громова ОА, Торшин ИЮ, Тапильская НИ, Галустян АН. Системнобиологический анализ синергидного воздействия прогестерона, витаминов и микроэлементов на нейропротекцию и развитие мозга плода. Вопросы гинекологии, акушерства и перинатологии. 2019;18(6):65-75. DOI: 10.20953/1726- 1678-2019-6-65-75
- Ших ЕВ, Махова АА. Ключевые микронутриенты репродуктивного периода – фолаты и докозагексаеновая омега-3 полиненасыщенная жирная кислота – в профилактике перинатальной депрессии. Вопросы гинекологии, акушерства и перинатологии. 2020;19(2):78-84. DOI: 10.20953/1726-1678-2020-2- 78-84
- Chen Y, Wang Y, Charkoftaki G, Orlicky DJ, Davidson E, Wan F, et al. Oxidative stress and genotoxicity in 1,4-dioxane liver toxicity as evidenced in a mouse model of glutathione deficiency. Sci Total Environ. 2022 Feb 1;806(Pt 2):150703. DOI: 10.1016/j.scitotenv.2021.150703
- Sugiura T, Dohi Y, Takase H, Yamashita S, Fujii S, Ohte N. Oxidative Stress is Closely Associated with Increased Arterial Stiffness, Especially in Aged Male Smokers without Previous Cardiovascular Events: A Cross-Sectional Study. J Atheroscler Thromb. 2017 Nov 1;24(11):1186-1198. DOI: 10.5551/jat.39289
- Оразов МР, Токтар ЛР, Семёнов ПА. Тазовая боль и аденомиоз – опасный тандем. Вопросы гинекологии, акушерства и перинатологии. 2020;19(3):110- 116. DOI: 10.20953/1726-1678-2020-3-110-116
- Доброхотова ЮЭ, Нариманова МР, Сапрыкина ЛВ, Ильина ИЮ, Мазо МЛ. Состояние молочных желез у женщин пременопаузального возраста с гиперплазией эндометрия. Медицинский совет. 2021;3:120-127. DOI: 10.21518/ 2079-701X-2021-1-120-127
- Morales-Prieto DM, Herrmann J, Osterwald H, Kochhar PS, Schleussner E, Markert UR, et al. Comparison of dienogest effects upon 3,3'-diindolylmethane supplementation in models of endometriosis and clinical cases. Reprod Biol. 2018 Sep;18(3):252-258. DOI: 10.1016/j.repbio.2018.07.002
- Dull AM, Moga MA, Dimienescu OG, Sechel G, Burtea V, Anastasiu CV. Therapeutic Approaches of Resveratrol on Endometriosis via Anti-Inflammatory and AntiAngiogenic Pathways. Molecules. 2019 Feb 13;24(4):667. DOI: 10.3390/ molecules24040667
- Gordon SC. Toxicological evaluation of ammonium 4,8-dioxa-3H-perfluorononanoate, a new emulsifier to replace ammonium perfluorooctanoate in fluoropolymer manufacturing. Regul Toxicol Pharmacol. 2011 Feb;59(1):64-80. DOI: 10.1016/j.yrtph.2010.09.008
- Zakharenko NF, Kovalenko NV, Manoliak IP. Clinical case report: conservative treatment of nodular adenomyosis. Womens Health. 2019;8(2):150-152.
- Кузнецова ИВ. Адъювантная терапия при миоме матки и генитальном эндометриозе. Эффективная фармакотерапия. 2021;17(19):20-30. DOI: 10.33978/ 2307-3586-2021-17-19-20-30
- Muderris T, Yar Sağlam AS, Unsal D, Mülazimoğlu S, Sevil E, Kayhan H. Efficiency of resveratrol in the prevention and treatment of age-related hearing loss. Exp Ther Med. 2022 Jan;23(1):40. DOI: 10.3892/etm.2021.10962
- Железнов БИ. Морфологические аспекты эндометриоза матки. Акушерство и гинекология. 1980;10:17-23.
- Stenchever MA, Ling FW. Comprehensive Gynecology Package. 4th Edition. Mosby, 2002.
- Подзолкова НМ, Подзолков ВИ, Брагина АЕ, Никитина ТИ. Динамика полиметаболических нарушений и митохондриальной дисфункции у женщин после гистерэктомии. Вопросы гинекологии, акушерства и перинатологии. 2019; 18(3):5-14. DOI: 10.20953/1726-1678-2019-3-5-14
- Хатламаджиян МГ, Харитонова ЕВ, Щербакова ЛН, Каленикова ЕИ, Медведев ОС, Алексеенкова МВ, и др. Роль антиоксидантов в комплексной терапии пациенток с эндометриоз-ассоциированным бесплодием. Вопросы гинекологии, акушерства и перинатологии. 2020;19(6):28-33. DOI: 10.20953/ 1726-1678-2020-6-28-33
Источник изображений на данной странице – Shutterstock / Fotodom.
